4 月 27 日,阿斯利康和第一三共共同宣布 HER2 ADC 药物 Enhertu 已获得 FDA 突破性疗法认定(BTD),用于既往接受过至少一种全身治疗后在辅助治疗六个月内复发或进展的 HER2 低表达(IHC 1+ or IHC 2+/ISH-阴性)不可切除或转移性乳腺癌患者。
这是 Enhertu 在乳腺癌中的第三个 BTD。Enhertu 此前曾在 2021 年和 2017 年获得针对二线 HER2 阳性转移性乳腺癌和后线 HER2 阳性转移性乳腺癌的突破性疗法认定。
DESTINY-Breast04 是一项随机、开放标签、全球多中心注册 III 期临床,评估 Enhertu(5.4 mg/kg)与医生选择的化疗(卡培他滨、艾日布林、吉西他滨、紫杉醇或白蛋白紫杉醇)在 HR 阳性 (n=480) 或 HR 阴性 (n=60) 的 HER2 低表达不可切除和/或转移性乳腺癌患者中的疗效和安全性,这些患者之前接受过一种或两种化疗方案。患者按 2:1 随机分组,分别接受 Enhertu 或化疗。主要终点为 BICR 评估的 HR 阳性患者的 PFS,关键次要终点包括 BICR 评估的所有患者 PFS、HR 阳性患者及所有患者的 OS。
结果显示,DESTINY-Breast04 达到了其主要终点,与 SOC 相比,Enhertu 在既往经治的 HR 阳性 HER2 低表达转移性乳腺癌患者中表现出更优的 PFS。同时,该试验也达到了所有关键次要终点,无论 HR 表达状态如何,均显著提高了患者 PFS 和 OS。安全性方面与既往临床试验一致,未发现新的安全信号。
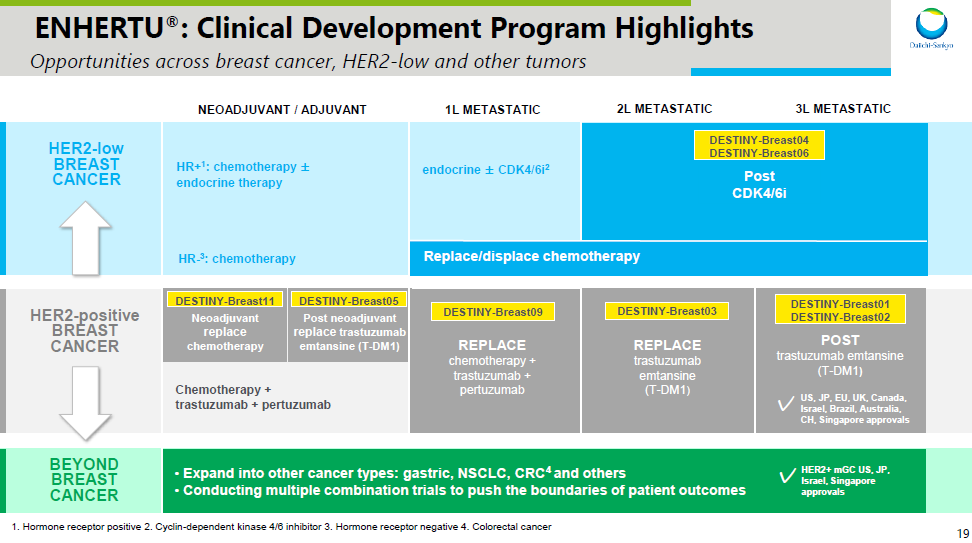
DESTINY-Breast04 研究的突破,有望助推阿斯利康和第一三共利用领先 ADC 药物覆盖乳腺癌治疗的全领域,包括在不同 HER2 表达状态和不同 HR 表达状态中的探索。同时在广覆盖之余,第一三共和阿斯利康还在推进这些疗法向更前线开发(详见下图)。在乳腺癌之后,还将探索 Enhertu 在胃癌(GC)、非小细胞肺癌(NSCLC)、结直肠癌(CRC)中的疗效(PPT 资料来自第一三共,可在公众号中回复「第一三共 2021」下载)。
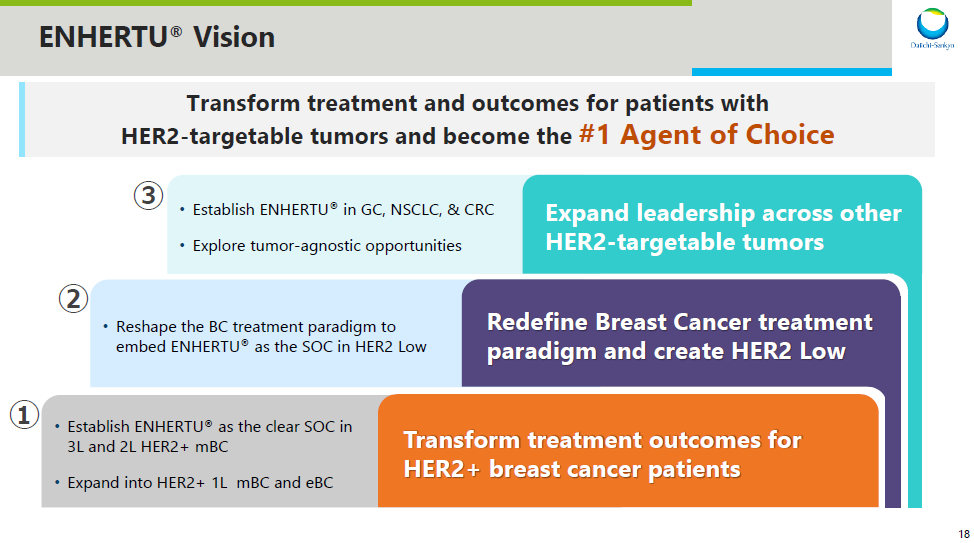
Enhertu(HER2)乳腺癌开发计划
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..