磷酸肌醇3-激酶 (PI3K) 是一个能够将磷脂酰肌醇磷酸化为磷酸肌醇的酶家族,是参与各种细胞信号传导和功能的重要二级信使。1988年Lewis C.Cantley和同事首次发现了该酶的存在。
PI3K介导的PI3K-AKT-mTOR信号转导通路被认为在细胞增殖、分化、凋亡和葡萄糖转运等细胞生命活动过程中发挥着关键作用,同时对肿瘤耐药性的产生具有较大影响。PI3K根据其结构和底物的特异性不同可分为Ⅰ型、Ⅱ型和Ⅲ型3类。其中,Ⅰ型PI3K是目前研究最深入的亚型。
根据结合亚基的不同,Ⅰ型可分为ⅠA型和ⅠB型。其中ⅠA型由受体酪氨酸激活,可分为PI3Kα、PI3Kβ和PI3Kδ,其催化亚基分别是p110α、p110β、p110δ,ⅠB型PI3K催化亚基主要为p110γ。
ⅠA型PI3K与肿瘤的发生发展密切相关,其中编译PI3Kα的基因PI3CA是肿瘤中最常见的突变,PI3KCA突变后异常激活PI3Kα的同时,还能抑制抑癌基因PTEN的表达,因此PI3Kα成为抗癌药物研发中极为重要的靶点。
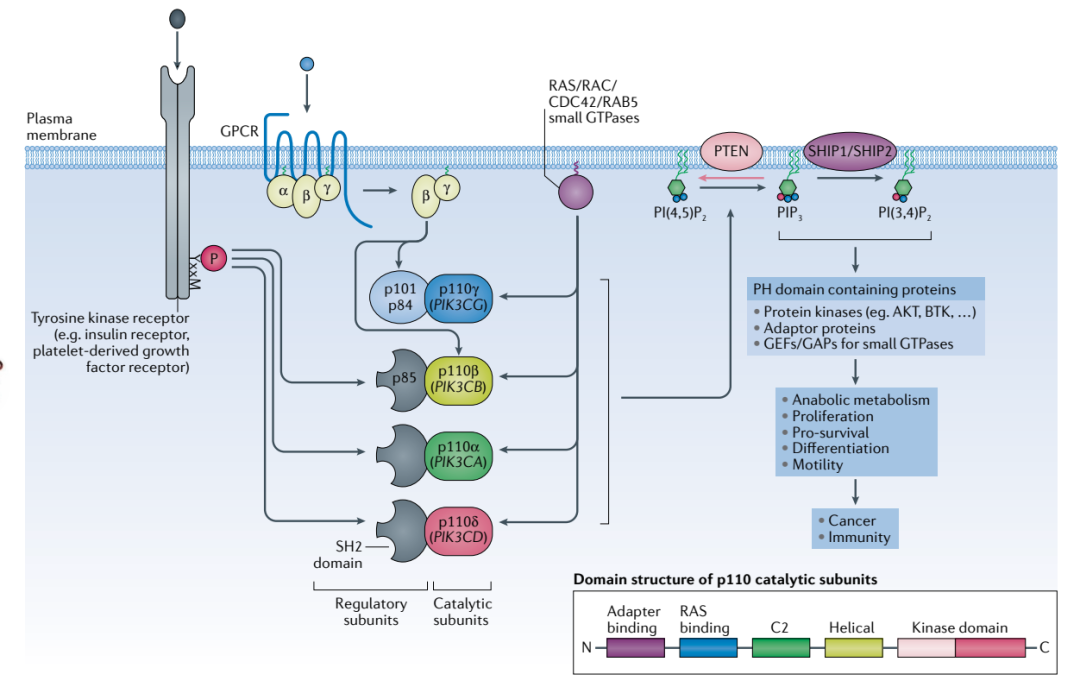
图1. Ι型PI3K信号通路图,来源:参考1
1
挫折中前进的PI3K抑制剂
在研发之初,由于PI3K下游的信号通路极其复杂,单纯抑制某种PI3K亚型可能会由于肿瘤细胞内的代偿机制而产生耐药,因此开发一款泛PI3K(pan-PI3K)抑制剂被认为是研发立项最佳的选择。
早期的PI3K靶向药研发也确实集中在这个方向,但泛PI3K抑制剂开发的最大挑战就是不良反应太强。作为一种激酶,PI3K在细胞内是冗余存在的。有研究证实,要想达到抑制肿瘤的效果,必须能够抑制PI3K至少90%的催化活性,这就势必要加大抑制剂的剂量。然而PI3K信号途径在正常细胞内也是不可或缺的(只是表达较低),大剂量的用药往往由于造成患者难以忍受的毒副作用而中断治疗。
2012年共有11款pan-PI3K抑制剂处于研发后期,大部分已经推进到了临床I期。然而由于毒副作用过强,到了2017年,11款产品中的10款已经终止研发,只有拜耳的Copanlisib走到最后并于2017年获批治疗复发性滤泡性淋巴瘤。
眼看pan-PI3K抑制剂研发这条路走不通,研究人员纷纷转向研发亚型特异性的PI3K抑制剂。
目前,全球共有五款PI3K抑制剂获批上市,分别是吉利德的Idelalisib、拜耳的Copanlisib、Verastem的Duvelisib、诺华的Alpelisib和TG Therapeutics的Umbralisib。除Copanlisib外,其余均为亚型选择性抑制剂。
2
已上市药物伴有多项黑框警告
适应证撤回事件频频发生
1
Idelalisib(Zydelig)
是由吉利德公司开发的一款高选择性PI3Kδ口服抑制剂。2014年7月,Idelalisib获FDA批准用于三种B细胞淋巴瘤的治疗,包括复发性慢性淋巴细胞白血病(CLL)、滤泡性淋巴瘤(FL)和小细胞淋巴瘤(SLL)。由于Idelalisib伴有多项黑框警告,包括肝脏毒性、严重腹泻或肠炎,以及肺炎和肠穿孔等副作用,临床使用中治疗中止率高达50%。
2016年3月在临床研究中出现感染相关死亡等严重不良事件,而先后遭到EMA和FDA的警告和调查,吉利德随后宣布暂停了Idelalisib的所有临床研究,表示不再寻求将Idelalisib开发成血液肿瘤的一线疗法。
另外,吉利德于2022年1月14日自愿撤回Idelalisib用于治疗FL和SLL的适应证。
2
Copanlisib(Aliqopa)
是拜耳公司研发的一款PI3Kα/δ抑制剂。2017年9月,FDA加速批准了Copanlisib用于治疗已接受过至少2线治疗后复发的FL患者。2021年7月,拜耳宣布Copanlisib和利妥昔单抗联用二线治疗非霍奇金淋巴瘤的上市申请已获NMPA药品审评中心受理。
拜耳于2022年1月28日在欧盟撤回Copanlisib用于治疗边缘区淋巴瘤 (MZL)的上市申请。
3
Duvelisib(Copiktra)
由Infinity最先研发,是一款PI3Kδ/γ抑制剂。2016年,Infinity将Duvelisib的开发和商业化权益授予Verastem Oncology。
2018年9月,Duvelisib获FDA批准上市,用于治疗既往至少经过二线治疗或者复发的FL患者。安全性方面,Duvelisib具有与Idelalisib类似的副作用和黑框警告。
Verastem Oncology于2021年12月3日自愿撤回Duvelisib用于治疗复发性或难治性FL适应证。
4
Alpelisib(Piqray)
是诺华公司研发的一款PI3Kα抑制剂。2019年5月,FDA批准Alpelisib与氟维司群联用治疗男性或绝经后妇女HR+/HER2-(激素受体阳性/HER2阴性)携带PIK3CA突变的晚期转移性乳腺癌。Alpelisib是首个获批实体瘤适应证的PI3K抑制剂。
Alpelisib已被纳入NCCN指南和ESMO指南,用于晚期乳腺癌的二线治疗,国内正在进行III期临床试验,预计2023年中旬结束。
5
Umbralisib(UKONIQ)
是TG Therapeutics公司研发的一款PI3Kδ和CK1ε抑制剂,CK1ε是一种癌蛋白翻译调节因子,与癌细胞包括淋巴恶性肿瘤发病机制相关。2021年2月,Umbralisib获FDA批准上市,用于二线治疗MZL和三线治疗FL。安全性方面,Umbralisib与Idelalisib类似。
Umbralisib曾被FDA调查是否会增加患者死亡的风险,并于2022年1月27日暂停了用于治疗CLL和SLL的临床试验。原因可能是基于确证性试验的性价比、治疗标准的变化或药物本身的不良反应等。
由上可知,由于毒副作用严重,批准上市的4款针对血液瘤的PI3K抑制剂产品无一幸免,都被调查或撤回上市申请。
另外,在3月24日,FDA拒绝批准了MEI Pharma的PI3K抑制剂新药zandelisib上市。Zandelisib是一款选择性PI3Kδ抑制剂,拟开发适应证为至少接受过两次系统治疗的FL患者的治疗。受此消息影响,公司当日股价大跌近60%。
聚焦国内,目前仅Duvelisib(度维利塞)获批上市,系石药集团从Verastem Oncology公司引进,适应证为既往至少经过两次系统治疗的复发或难治性FL患者。此外,临床进展居前的还有恒瑞医药/璎黎药业(linperlisib,PI3Kδ抑制剂)、阿诺医药(Buparlisib,泛PI3K抑制剂)、百济神州(BGB-10188,PI3Kδ抑制剂)等。
3
小结
由于PI3K-AKT-mTOR是肿瘤发生的经典通路,科学家几十年来对PI3K的研究非常多,作为一个成熟靶点,其靶向抑制剂研发也一直是资本追逐的热点,但是PI3K抑制剂的高毒性成为应用于临床所面临的巨大挑战。
这也强调了剂量和给药方案的优化作为增加其治疗效果的一种关键解决方案的重要性。同时,保持高抗癌活性、同时具备更低毒性的新一代PI3K抑制剂存在巨大市场需求。这需要更多科学家们对该通路进行更深入的研究。
参考资料:
1.Vanhaesebroeck B, Perry MWD, Brown JR, André F, Okkenhaug K. PI3K inhibitors are finally coming of age [published correction appears in Nat Rev Drug Discov. 2021 Sep 1;:]. Nat Rev Drug Discov. 2021;20(10):741-769. doi:10.1038/s41573-021-00209-1.
2.https://www.medicilon.com.cn/hang-ye-zi-xun/pdkzlywpi3kyzjdzxyjjz.shtml.
3.https://www.fda.gov/drugs/development-approval-process-drugs/fda-investigating-possible-increased-risk-death-lymphoma-medicine-ukoniq-umbralisib.
专栏作者
小时光
生化与分子生物学背景,曾从事食管鳞癌的分子分型工作,熟悉各实体瘤的发病机制和用药方案。现以发现和传播知识为谋生手段,学无止境,希望自己永远保持谦虚的心态和可塑性,和各位同道一起迎接医药领域的黄金时代。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..