近年来,以基因和细胞疗法为主的再生医学领域被认为是未来的一种重要治疗选择。现在,该领域发展的步伐正在以极快的速度向前推进。美国再生医学联盟(ARM)近期发布的2021年上半年报告显示,2021年以来,再生医学领域已经取得多项“突破”。

融资金额有望再破记录
再生医学和先进疗法在2021年上半年筹集了141亿美元资金,比2020年上半年增长了35%,融资金额飙升至新的高度,已经是2020年全年筹集资金的71%。
该行业的投资激增使2021年上半年成为有记录以来最强劲的半年,2021年全年融资金额有望超越2020年,尽管面临冠状病毒病大流行挑战,该行业去年仍以近200亿美元的融资金额打破了融资记录。
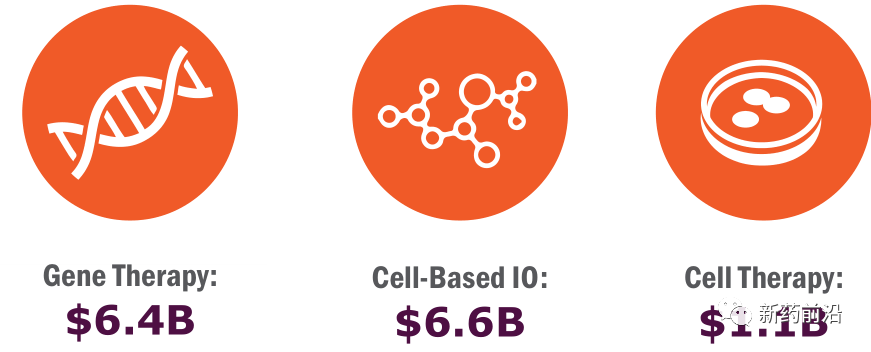
基于细胞的免疫肿瘤学(IO)融资首次超过基因疗法,在2021年上半年筹集了66亿美元。基因疗法开发者筹集了64亿美元,细胞疗法开发者筹集了11亿美元。
随着再生医学领域的发展,对内部和外部制造能力的需求不断增长。
较小的细胞和基因治疗合同开发和制造组织(CDMO)是有吸引力的收购目标,推动今年上半年宣布的合并和收购超过108亿美元。

其中包括丹纳赫以96亿美元收购质粒、mRNA和蛋白质制造商Aldevron,以及Charles River Laboratories分别以8.75亿美元和2.93亿美元收购CDMO公司Cognate BioServices和Vigene Biosciences。
也有公司在建设内部产能并投资于新的制造设施,例如BioNTech最近从Kite Pharma收购了一家细胞治疗设施。
批准数量创新高
2021年有望迎来全球新再生医学和先进疗法获批的分水岭。
预计6个地区的监管机构将针对18种再生医学产品做出批准决定,其中10种是之前从未在任何地区获得批准的产品——这意味着新产品的批准可能超过2016年创下的9种记录。
其中4种已经获得批准:百时美施贵宝的Breyanzi、蓝鸟生物/百时美施贵宝的Abecma以及Mallinckrodt的Stratagraft均获得FDA批准,而蓝鸟生物的Skysona在欧洲获得批准。其中3种产品Breyanzi、Abecma和Skysona是基因疗法/基因修饰细胞疗法,这意味着2021年可能会成为此类产品新批准的创纪录年份。
预计今年将对另外4种基因治疗/基因修饰细胞治疗产品做出决定,总共有可能获得七项批准——这将是2017年之前记录三项的两倍多。2021年迄今为止已有两种产品是通过再生医学先进疗法资格(RMAT)获得首批上市的:Breyanzi,用于复发或难治性大B细胞淋巴瘤的CAR-T疗法,以及Stratagraft,用于严重烧伤的再生皮肤组织疗法。此外,用于治疗多发性骨髓瘤的Abecma是首个获批的BCMA靶向CAR-T疗法。复星凯特的Yescarta成为第一个在中国获得批准的CAR-T疗法。
临床试验的里程碑
目前,全球有1320项行业赞助的再生医学和先进疗法试验正在进行中。自2020年底以来,增加了100项试验,亚太地区是主要增长中心。另外还有由包括学术中心和政府非行业团体赞助的1328项试验正在进行。与行业赞助的试验相比,非行业团体赞助的试验3期比例较低(6%对12%),细胞治疗试验的比例较高(59%对39%)和基因治疗试验的比例较低(6%对22%)。
3期阶段试验有243项,包括158项由行业赞助的试验和85项由学术、政府和其他机构赞助的试验,说明该领域研发管线的成熟度。这些晚期候选产品正对多种适应症,包括糖尿病神经病变、心力衰竭、罕见遗传疾病和肌萎缩侧索硬化症(ALS)等神经肌肉疾病进行测试。
尽管自2020年底以来,正在进行的行业赞助的临床试验数量略有减少,但预计未来几年临床前景将显著增长。目前有956种独特疗法正在开发中,其中136种处于3期阶段。预测到2026年,这一数字将增长到3100多种,其中355种将进入到3期阶段。
CAR-T领域持续推进。除了Abecma,这是第一个批准的BCMA靶向CAR-T疗法,越来越多的BCMA靶向CAR-T疗法将公布数据。
强生和Legend Biotech于6月公布了BCMA靶向CAR-T疗法cilta-cel的数据,显示多发性骨髓瘤的总体缓解率为98%,严格的完全缓解率为80%,而EMA和FDA预计今年晚些时候对cilta-cel做出了批准决定。
Precision BioSciences和CRISPR Therapeutics各自开发的BCMA靶向CAR-T疗法的试验数据也有望在今年晚些时候公布。
随着开发人员希望使用CAR-T疗法来治疗更广泛的血液肿瘤和实体肿瘤,临床试验的将会持续增长。
基因编辑也在临床上不断进步。
近期,Intellia Therapeutics宣布了一项有希望的转甲状腺素蛋白(ATTR)淀粉样变性试验的临床数据——这是体内CRISPR疗法的第一个数据:NTLA-2001将转甲状腺素蛋白(一种有害肝脏蛋白质)的血清水平降低了87%,优于通常达到80%的标准疗法。
从CRISPR Therapeutics和Vertex Pharmaceuticals得到的关于镰状细胞病基因编辑疗法的数据:所有15名接受治疗的β地中海贫血患者均不依赖输血,所有7名镰状细胞病患者均未出现血管闭塞危象。在CRISPR领域之外,Homology Medicines报告数据显示,在使用其同源重组基因编辑技术治疗甲基丙二酸血症的试验中对第一位患者给药,该试验是首次在儿科患者中进行的体内基因编辑试验。
亚太地区超欧追美
值得一提的是,作为再生医学曾经的领航者之一,欧洲面临落后的风险,无论开发者数量和新临床试验远远落后于美国和亚洲在过去三年中发展的速度。
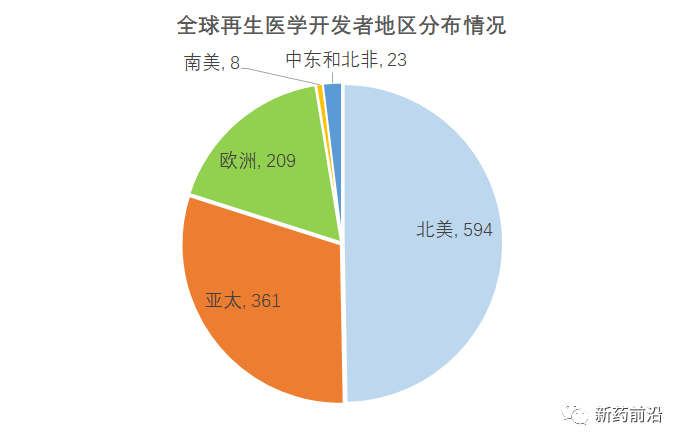
全球有近1200家公司积极参与再生医学和先进疗法开发,比去年同期增加了近200家。自2018年以来,欧洲的再生医学和先进疗法开发者数量减少了4%,而美国增加了23%,亚太地区增加了119%。
从2018年到2021年上半年,欧洲启动了224项由行业赞助的新再生医学试验,而美国(597项)和亚太地区(473项)启动的数量是这一数字的两倍多。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..