最近一项对临床试验透明度的最新研究发现,2016-2017 两年间,只有 26% 的制药商公开了所有用于获得药物批准的研究结果。67% 的药物在获得 FDA 批准后 6 个月内公布了临床试验结果,但只有 58% 符合《FDA 修正案》的临床试验披露要求。11% 的药物在批准时没有公布任何法律要求报告结果的试验。
整体来说,大企业比小企业更加透明。在所有试验结果的公开可用方面,生物制品和药品之间存在统计学上的显著差异:85% 对 47%。值得注意的是,几乎所有的生物制品(22 个中的 19 个)都是由大企业开发的。企业规模由市值决定。
这一分析发表在《英国医学杂志》BMJ Open 上,分析目的从标题上可一窥究竟“生物制药公司之间的临床试验透明度和数据共享以及公司规模、地点和产品类型的作用:横断面描述性分析”[1]。研究体现了对临床试验数据披露的担忧。医生通常依靠数据来了解药物的疗效,以便做出治疗决策。如果无法获得已发表的结果,独立研究人员几乎不可能计划未来的研究或验证可以改善治疗、改善医疗保健以及降低成本的研究结果。
研究的通讯作者、耶鲁大学医学院助理教授 Jennifer Miller 表示,“研究透明度对患者护理以及药物和疫苗开发具有明显好处。通过对临床试验有可能产生的可概括的知识来论证伦理上的合理性。如果结果和数据不能得到公开,则通常无法满足这一伦理论证要求。”她补充指出,透明度有助于资助组织的决策者避免支持重复研究,重复研究可能导致试验参与者承担不必要的风险。
Miller 还是生物伦理学国际组织的负责人,该组织几年前开发了 Good Pharma Scorecard(计分卡),对制药企业的公共卫生活动进行排名,以更密切地跟踪最大型的制药商。最新的这一研究分析就是在计分卡的基础上进行的。
研究发现,在大多数情况下,这些制药商的表现欠佳。计分卡不仅仅依赖于在联邦政府数据库中注册的时间,而且还评估试验注册、结果报告、发布、对联邦法律的遵守情况以及共享患者级数据的实践。
Miller 和研究人员团队根据企业规模、总部位置和所研究的药物类型评估了透明度和数据共享实践的变化。他们解释指出,他们的研究反映了一个事实,即大企业仅申办每年批准的所有新药的一半左右,而更多美国以外的公司在寻求 FDA 的批准。
那么哪些企业获得了好成绩呢?在药物获得 FDA 批准的 42 家企业中,表现最好的是 AbbVie、Amgen、拜耳、诺华、罗氏和武田,均获得 100 份的评分。垫底的是 PTC Therapeutics,仅获得 11 分。中位分数是 73 分。评分详见下表。
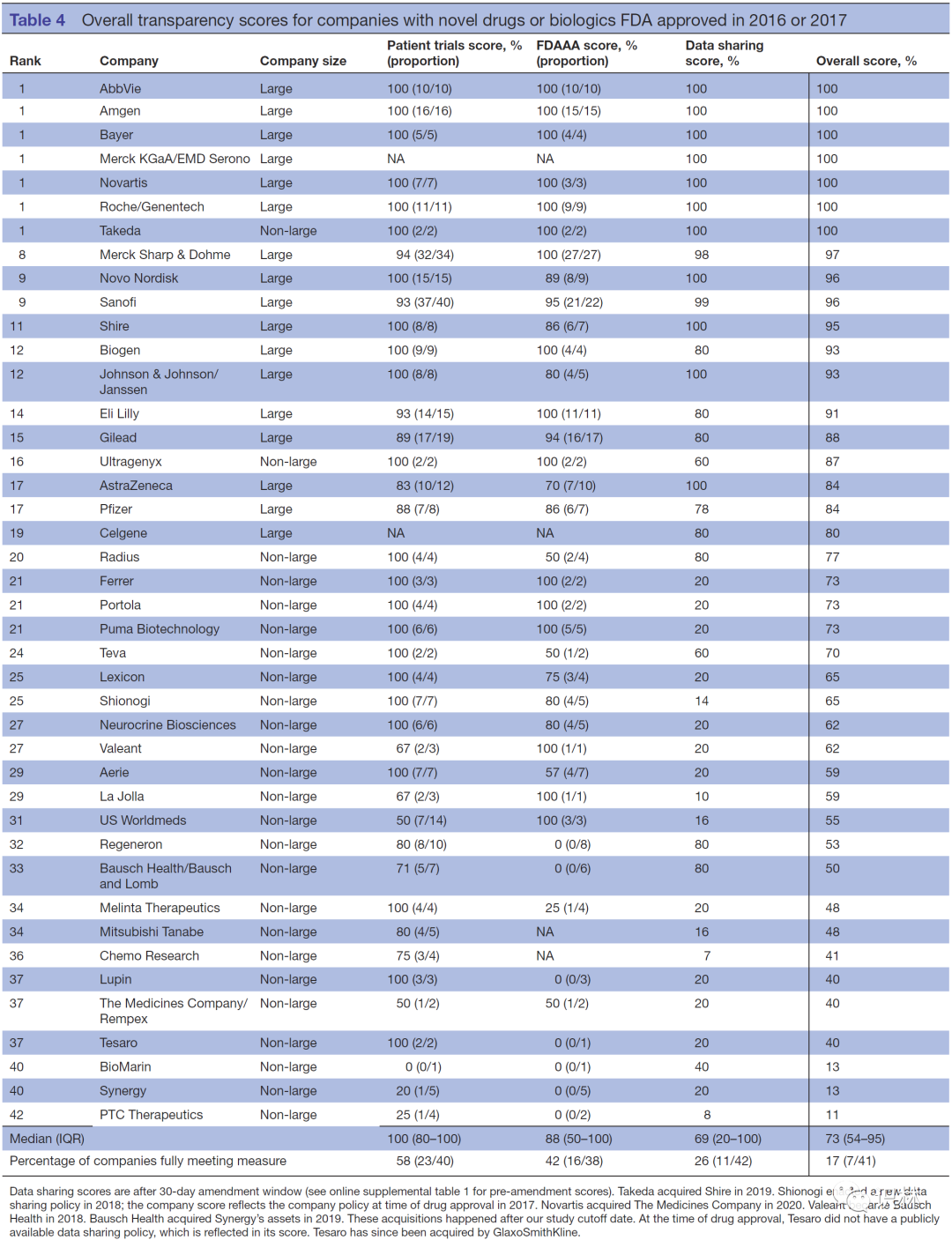
图表来自参考文献[1]
在讨论研究发现时,Miller 指出,由于资源有限和监管合规经验不足,小企业可能会落后。为解决这一问题,她建议与较小企业合作的大型制药商可以审计小企业的实践。她指出,“大企业中的透明度缺陷通常是与小企业合作的结果。”
但鉴于只有 58% 的试验符合注册和披露获批药物试验结果的法律要求,Miller 建议 FDA 应更积极地执法。“尽管已经有几项研究表明制药企业的合规性较差,但 FDA 尚未系统地惩罚”不遵守法律的企业。另外,考虑到 11% 的药物在批准时没有公布任何法律要求公开结果的试验,Miller 认为这是法律范围太窄导致的。一种可能性是“越来越多的 FDA 批准的产品基于的是正在进行的试验以及由总部位于其他地方的企业所提供的完全在美国境外进行的试验。”
在制药商未公开共享安全性或有效性数据的几起丑闻之后,有关临床试验结果公开的问题引发了越来越多的争论。与此同时,越来越多的抽查发现,制药企业和大学都经常未能正确注册登记或报告试验数据。反过来,不同国家的监管机构也被迫更密切地跟踪这些披露问题。【FDA 对未能公开临床试验结果的企业发出首封不合规罚款通知 2021/04/30】;【临床试验结果公开:三年没公开 , 收到罚款通知后两天完成数据提交 2021/05/28】;【临床试验结果公开初现成效?大多数临床试验仍未能及时报告 2021/06/01】
最近一份报告发现欧洲注册数据库中的临床试验数据的质量和可用性存在“显著差距”。作为对批评的回应,欧盟药品机构(HMA)最近透露,计划与欧盟委员会和欧洲药品管理局(EMA)发起“联合行动” , 以加强制药商和大学的临床试验报告。【欧洲多国监管机构未能确保临床试验数据公开 2021/07/08】
WHO 和国际药品监管机构联盟(ICMRA)于 5 月初发表联合声明敦促制药商在不编辑任何机密信息的情况下发布新药和疫苗的临床研究报告。两机构表示,发布未经编辑的试验信息将增强公众对医药产品的信心。【WHO 和 ICMRA 呼吁提高临床试验数据透明度,不遮掩任何保密信息 2021/05/12】
[1] Axson S, Mello MM, Lincow D, et alClinical trial transparency and data sharing among biopharmaceutical companies and the role of company size, location and product type: a cross-sectional descriptive analysisBMJ Open 2021;11:e053248. doi: 10.1136/bmjopen-2021-053248
作者:识林-蓝杉
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..