今日,默沙东宣布自愿撤回一项在美国加速批准的 Keytruda 适应症,用于治疗在二线及后线治疗后进展的 PD-L1 阳性局部晚期或转移性胃及胃食管交界处(GEJ)腺癌。这一决定是 4 月 29 日肿瘤药物咨询委员会以 6:2 建议撤销该适应症之后,默沙东与 FDA 协商而作出的。按照与 FDA 的约定,默克将在六个月内开始撤回这一适应症。
Keytruda 最初于 2017 年 9 月基于 Keynote-059 研究获 FDA 加速批准,三线治疗 PD-L1 阳性胃及胃食管交界处癌。不过在同年 12 月,默沙东即宣布针对胃癌的 3 期临床 Keynote-061 的失败,后续 Keynote-062 也宣告失败,这两项临床分别将 K 药用于胃癌二线及一线治疗。
这两项临床分别在 2018 年和 2019 年的 ASCO 会议上公布了阴性结果。结果显示,虽然安全性优于化疗,但两项临床均未达到预定的 CPS≥1 人群中 OS 和 PFS。亚组分析发现,Keytruda 单药在 CPS≥10 人群中可观察到获益,但这部分人群在整体患者中占比较低。
默沙东的临床研究副总裁 Scot Ebbinghaus 博士表示,「虽然对于经过多种前线治疗的晚期胃癌患者的需求仍未得到满足,但我们认识到治疗领域已经发生了变化,我们尊重 FDA 不断评估加速批准的努力。KEYTRUDA 的研究促进了胃癌治疗的最新进展,默沙东将继续推进研究以帮助更多患有这种疾病的患者。」
当前,默沙东在胃癌领域还有另外几项已获批的适应症,均为加速批准:联合曲妥珠单抗、氟嘧啶和含铂化疗一线治疗局部晚期不可切除或转移性 HER2 阳性胃或 GEJ 腺癌患者;MSI-H/dMMR 实体瘤;不可切除或转移性的肿瘤突变负荷稿(TMB-H)实体瘤。
从临床项目来看,默克的胃癌临床项目还包括一线 3 期研究 KEYNOTE-811、KEYNOTE-859 和 LEAP-015,以及新辅助和辅助治疗环境中的 KEYNOTE-585。
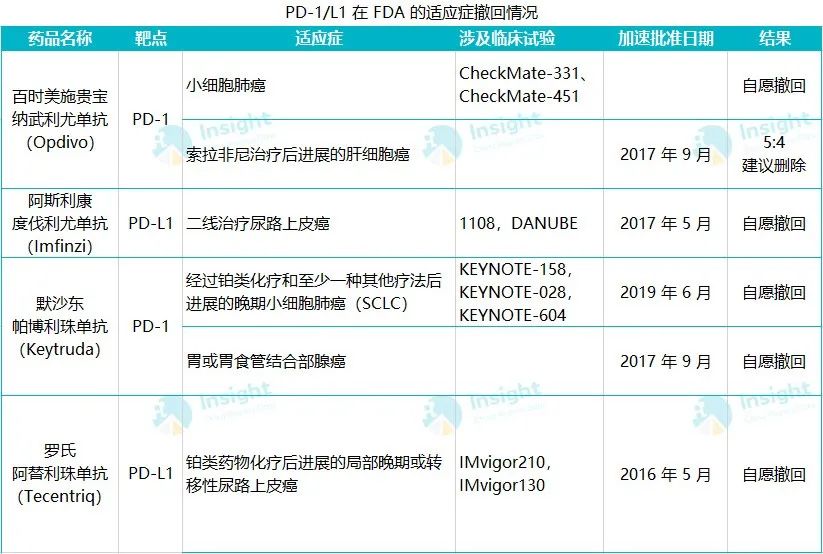
PD-1/L1 在 FDA 的适应症撤销情况
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..