4 月 27 日 - 29 日,FDA 针对 PD-1/L1 单抗的 6 项加速批准但后续临床失败的适应症召开会议,征询肿瘤药物咨询委员会(ODAC)专家的意见,以作出保留或撤回的最终决定。
这 6 项适应症包括默沙东 K 药的 3 个适应症、罗氏 T 药的 2 个适应症以及施贵宝 O 药的 1 个适应症。此前,这些重磅品种已经连续撤销了膀胱癌和小细胞肺癌的 4 项适应症。
如今,全部结果已经出来了。其中 4 项适应症获得了肿瘤咨询委员会专家的支持,建议保留;但 K 药和 O 药各有一项适应症被专家否定:Keytruda 三线胃癌适应症以 6:2 票数建议撤销;Opdivo 二线肝细胞癌适应症以 5:4 的票数建议撤销。不过,FDA 的最终决定还未做出,会多大程度上参考专家们的意见尚且未知。以下为 FDA 会议的结果:
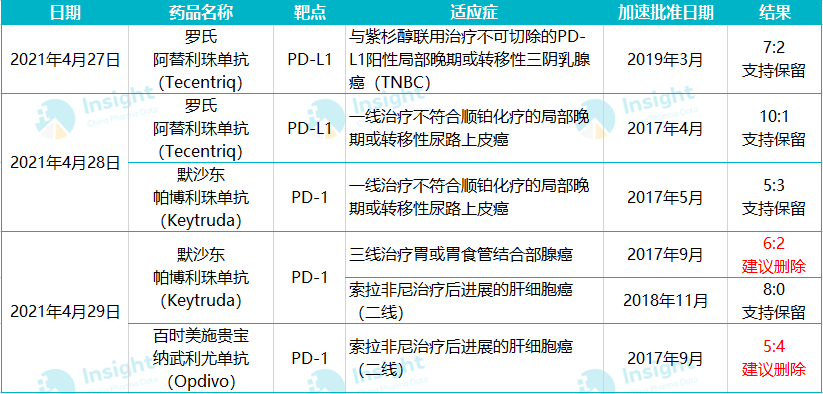
同为 PD-1 单抗,K 药和 O 药的肝细胞癌和胃癌适应症却走出了不一样的结局。K 药三线胃癌适应症被建议撤销,临床冲击二线、一线失败,而 O 药日前以优异的 3 期临床数据成为了首个获批一线治疗胃癌的免疫疗法;但在肝细胞癌二线治疗方面,FDA 肿瘤药物咨询委员会分别以 8:0 和 4:5 的票数支持了 K 药,否决了 O 药。
胃癌
Keytruda 最初于 2017 年 9 月基于 Keynote-059 研究获 FDA 加速批准,三线治疗 PD-L1 阳性胃及胃食管交界处癌。不过在同年 12 月,默沙东即宣布针对胃癌的 3 期临床 Keynote-061 的失败,后续 Keynote-062 也宣告失败,这两项临床分别将 K 药用于胃癌二线及一线治疗。
这两项临床分别在 2018 年和 2019 年的 ASCO 会议上公布了阴性结果。结果显示,虽然安全性优于化疗,但两项临床均未达到预定的 CPS≥1 人群中 OS 和 PFS。亚组分析发现,Keytruda 单药在 CPS≥10 人群中可观察到获益,但这部分人群在整体患者中占比较低。
与此形成对比的是,BMS 的 O 药日前基于 Checkmate-649 的积极结果获批联合化疗用于治疗晚期或转移性胃癌、胃食管结合部癌和食管腺癌,成为首款获 FDA 批准用于一线胃癌的免疫疗法。
Checkmate-649 试验结果显示,无论是在所有随机化患者(OS HR 0.80; 95% CI: 0.71 to 0.90; P=0.0002)还是 PD-L1 合并阳性评分(CPS)≥5 的患者(OS HR 0.71; 95%CI:0.61 至 0.83; P <0.0001)中,Opdivo 联合化疗相比单独化疗显著延长了患者的总生存期(OS)。
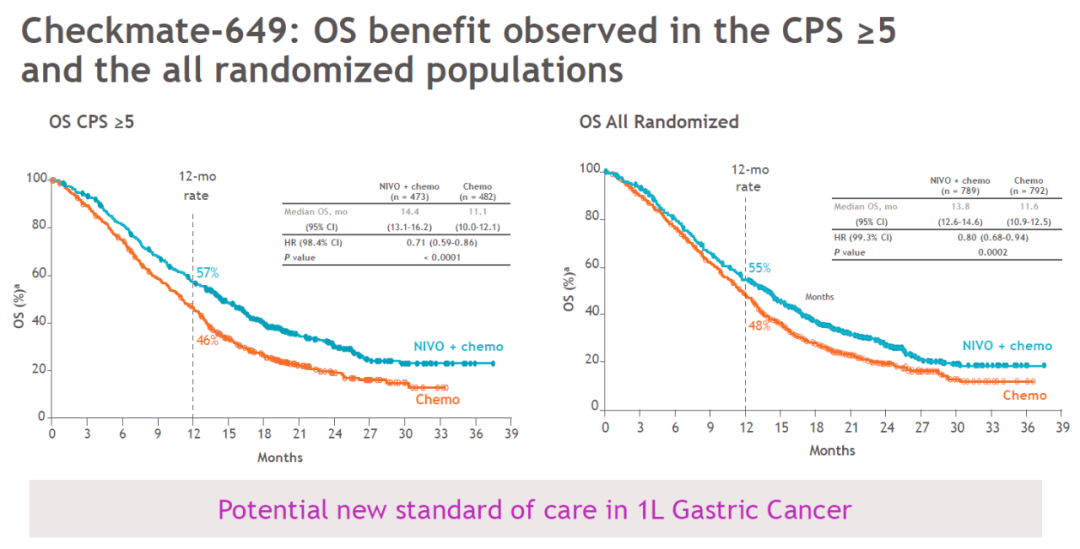
在对所有患者的探索性分析中,接受 Opdivo 联合化疗的患者中一年后生存率为 55% ,而只接受化疗的患者为 48%。与化疗相比,该组合还降低了 20% 的死亡风险。
BMS 还公布了关键 III 期研究 CheckMate -649 中国亚组的主要结果。在中国人群中,与单独化疗相比,欧狄沃(纳武利尤单抗)联合化疗一线治疗不可切除的晚期或转移性胃癌、胃食管连接部癌,取得了具有临床意义的总生存期(OS)及无进展生存期(PFS)获益。无论 PD-L1 表达阳性且联合阳性评分(CPS)≥5、CPS≥1 的患者,还是所有随机人群,均观察到 OS 及 PFS 获益。这与全球整体人群中的观察结果一致。
肝细胞癌
K 药于 2018 年 11 月基于 Keynote-224 获批用于既往接受索拉非尼治疗后进展的肝细胞癌患者。在该项临床中,Keytruda 治疗组的 ORR 达到 17% (n = 104; 95% CI, 11%-26%) ,89% 的患者在 6 个月后仍有应答,56% 的患者在 12 个月后仍有应答。
该项适应症后续的正式批准取决于验证性临床 Keynote-240。然而,这项研究未能达到其 OS 和 PFS 主要终点。结果显示,Keytruda 治疗组的中位 PFS 为 3 个月,而安慰剂组为 2.8 个月 (HR, 0.775; 95% CI, 609-987; P = .0186);中位 OS 为 13.9 个月 vs 10.6 个月 (HR, 0.781; 95% CI, 0.611-0.998; P = .0238)。
不过,这项试验结果中的 ORR 数据与此前的 Keynote-224 基本一致,为 18.3% (95% CI, 14.0%-23.4%),而安慰剂组为 4.4% (95% CI, 1.6%-9.4%)。投票支持 Keytruda 的专家认为,尽管未达到主要终点,这项临床仍然证实了 K 药在 Keynote-224 中观察到的疗效。最终,Keytruda 以 8:0 的压倒性结果继续保持这项加速批准。
对于这次积极结果,默沙东表示,很高兴能够继续为肝癌患者提供帕博利珠单抗这一治疗选择,后续公司将继续积极通过临床试验向 FDA 更新数据。FDA 已经接受 2 项 3 期临床 Keynote-394 和 LEAP-002 以满足上市后要求。
不过,O 药在这项适应症上遭受了挫折。尽管票数很接近,ODAC 专家们以 5:4 的投票建议撤销这项加速批准。该项适应症是在 2017 年 9 月基于 Checkmate-040 研究获得加速批准的,但在后续 3 期临床 Checkmate-459 中,O 药同样未能达到其主要终点 OS,不过其 ORR 数据也与先前加速批准的数据相一致。
BMS 表示,他们正致力于完成数项正在进行的 3 期试验,这些试验可能证明 O 药的临床益处,包括 CheckMate-9DX,CheckMate-9DW 和 CheckMate-74W。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..