NLRP3炎性体是一种多聚体细胞溶质蛋白复合物,可响应细胞扰动而组装。该组装导致胱天蛋白酶-1的活化,其促进炎性细胞因子白细胞介素-1β(IL-1β)和IL-18的成熟和释放,以及炎性细胞死亡。
基于此,Sharma 教授团队在《Nature Immunology 》期刊上发表题为“NLRP3 inflammasome in cancer and metabolic diseases”的论文介绍NLRP3炎性体激活的机制及其在炎症相关疾病(如癌症,动脉粥样硬化,糖尿病和肥胖症)发病机制中的不同作用,突出了靶向该途径的治疗潜力。

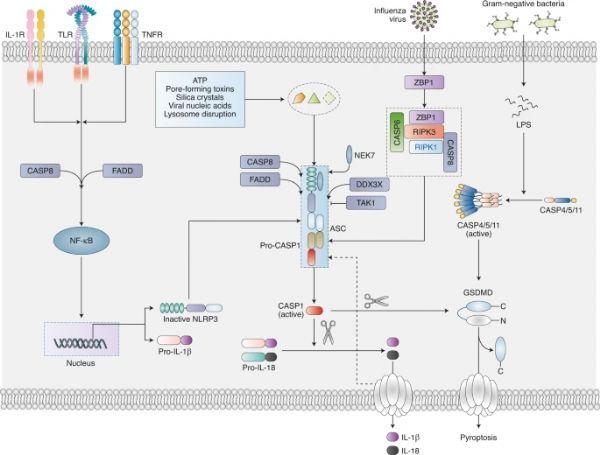
先天免疫系统识别致病性损伤以及体内死亡和缺陷细胞以启动保护性反应。这种识别通过一组种系编码的模式识别受体(PRR)发生,这些受体感知病原体相关分子模式(PAMP)和损伤相关分子模式(DAMP)。膜结合的PRR分为Toll样受体(TLR)和C型凝集素受体。细胞质PRR包括NOD样受体(NLR),视黄酸诱导基因-I样受体(也称为RIG-I样受体)并且在黑素瘤中不存在。NLR识别来自各种微生物病原体,宿主细胞和环境来源的配体。根据其域架构,NLR细分为NLRP和NLRC。其中,NLRP1(小鼠NLRP1b),NLRP3和NLR家族凋亡抑制蛋白/NLRC4因其组装炎性体的能力而成为公认的NLRs3。炎性体是响应于DAMP和PAMP而组装的多聚体胞质蛋白复合物,导致炎症反应的激活。炎症小体组装引发炎症形式的细胞死亡,称为pyroptosis,触发促炎细胞因子白细胞介素-1的释放β (白细胞介素-1β) 和IL-18。NLRP3炎性体响应细胞扰动和各种各样的微生物。
NLRP3是具有三个结构域的胞质蛋白:在羧基末端富含亮氨酸的重复序列,具有ATP酶活性的中心核苷酸结合和寡聚化结构域(NACHT)和在氨基末端的pyrin结构域(PYD)11。NLRP3表达的基础水平通常不足以用于NLRP3炎性体激活。因此,需要两步启动和激活过程。引发步骤由TLR和细胞因子受体诱导,例如肿瘤坏死因子(TNF)受体或IL-1受体(IL-1R),其识别PAMP或DAMP并上调NLRP3和IL1B的转录.PAMP和DAMP然后促进NLRP3炎性体组装,从而导致caspase-1(CASP1)介导的炎性细胞因子成熟和释放,以及pyroptosis。这些PAMP和DAMP可包括来自革兰氏阳性和革兰氏阴性细菌,病毒,真菌或原生动物病原体或宿主衍生部分的微生物活化剂,例如细胞外ATP,尿酸晶体,磷酸钙二水合物,胆固醇晶体或葡萄糖。然而,在人单核细胞中,单独的引发步骤足以介导CASP1活化和IL-1β释放。在这些细胞中,脂多糖(LPS)诱导内源性ATP的释放,然后激活P2X7受体以触发NLRP3炎性体激活和IL-1β成熟。另一种NLRP3炎症小体途径也在人单核细胞中响应LPS而被激活,其中受体相互作用的丝氨酸/苏氨酸蛋白激酶1(RIPK1),Fas相关死亡结构域蛋白(FADD)和CASP8是TLR4-Toll或含白细胞介素-1受体结构域的衔接子诱导干扰素-β(TRIF)信号传导下游所必需的。然而,需要更多的研究来充分了解人和小鼠中NLRP3活化之间的相似性和差异。
最后,NLRP3还可以与适应性免疫系统相互作用以驱动其他肿瘤类型的癌发生。巨噬细胞中的NLRP3信号传导驱动CD4+T细胞分化为胰腺癌中促进肿瘤的T辅助细胞2型(TH2),TH17和Treg细胞群并抑制TH1细胞极化和细胞毒性CD8+T细胞活化,表明NLRP3可能是一种新的免疫疗法重新编程肿瘤的有吸引力的目标针对免疫原性先天性和适应性炎症表型的微环境。NLRP3限制树突状细胞疫苗接种后的抗肿瘤T细胞免疫,表明需要新方法通过限制NLRP3信号传导来改善对抗肿瘤疫苗的反应。NLRP3在肿瘤微环境中的表达可能通过促进MDSC向肿瘤部位的迁移而降低抗肿瘤免疫力和疫苗效力。组织蛋白酶B释放后5-氟尿嘧啶和吉西他滨对MDSCs中NLRP3炎性体的激活限制了这些化疗药物的抗肿瘤功效。IL-1β调节相邻细胞中的CD4+T辅助细胞极化并驱动产生IL-17的TH17亚群的形成,IL-17通过增强免疫抑制剂MDSC向肿瘤部位的出现并减少肿瘤浸润而在肿瘤发病机制和进展中起积极作用。通过细胞毒性T细胞。根据这些发现,最近的一项研究发现,肿瘤细胞中NLRP3介导的IL-1β产生通过建立由M2巨噬细胞,MDSCs,CD45+调节性B细胞和TH17细胞介导的免疫抑制环境来产生促肿瘤发生的胰腺导管腺癌微环境。
综上所述,炎性细胞因子有助于全身性低度炎症的发展,并且异常的NLRP3活化可以驱动体内的慢性炎症状态以调节炎症相关疾病的发病机理。因此,靶向NLRP3或下游的其他信号分子,例如半胱天冬酶-1,IL-1β或IL-18,具有很大治疗益处的潜力。然而,NLRP3炎性体介导的炎性细胞因子在介导人类疾病中起双重作用。虽然它们在炎症和代谢疾病的发病机理中是有害的,但它们在许多传染病和一些癌症中具有有益作用。因此,微调NLRP3炎性体活性对于维持适当的细胞稳态和健康至关重要。(生物谷Bioon.com)
原始出处
Sharma, B.R., Kanneganti, TD. NLRP3 inflammasome in cancer and metabolic diseases. Nat Immunol (2021). https://doi.org/10.1038/s41590-021-00886-5
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..