日前,赛诺菲(Sanofi)公司宣布,美国FDA已接受该公司为avalglucosidase alfa递交的生物制品许可申请(BLA),用于作为长期酶替代疗法治疗糖原累积病(Ⅰ型、Ⅱ型)(又名庞贝病,Pompe disease)患者。FDA同时授予这一申请优先审评资格,预计在明年5月8日之前做出回复。
庞贝病是一种罕见的退行性肌肉疾病,会影响个体的移动和呼吸能力。在美国,估计有3500人患有此病,从婴儿期到成年期,任何年龄均可发病。它是由于溶酶体中的酸性α-葡萄糖苷酶(GAA)的遗传缺陷或功能障碍引起的,导致全身肌肉细胞中糖原的积累,最终导致肌肉的不可逆损伤,包括支持肺功能的呼吸肌和膈肌,以及影响活动能力的其他骨骼肌。
Avalglucosidase alfa是一种在研酶替代疗法,旨在改善GAA向肌肉细胞的递送。为了减少糖原积累,GAA必须被递送到肌肉细胞内的溶酶体中。赛诺菲领导的研究主要集中在通过靶向在GAA运输中起关键作用的甘露糖-6-磷酸(M6P)受体,来增强GAA向肌肉细胞溶酶体中的递送。与标准治疗α-葡萄糖苷酶相比,avalglucosidase alfa的M6P含量增加约15倍,旨在帮助改善细胞对酶的摄取并增强目标糖原清除。这款在研疗法已经被FDA授予突破性疗法认定和快速通道资格,用于治疗庞贝病。如果获批,将为这些患者提供一种潜在的新标准治疗。
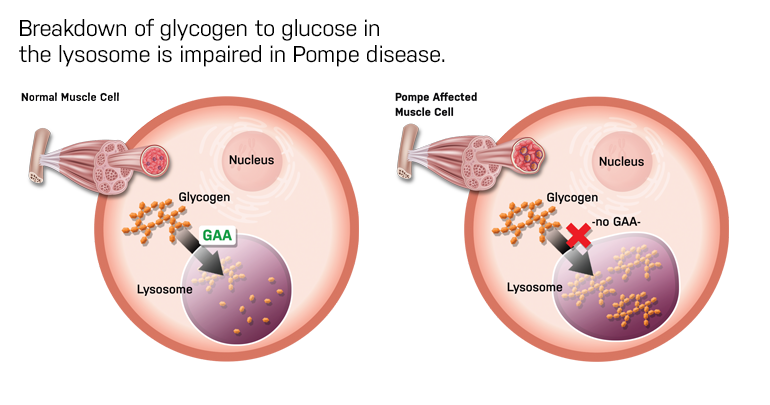
▲庞贝病(Pompe disease)患者的糖原降解出现缺陷(图片来源:pompe.com)
这一BLA是基于两项临床试验的结果。一项为关键性双盲药物对照3期临床试验,在晚发型庞贝病患者中评估avalglucosidase alfa与α-葡萄糖苷酶(标准治疗)相比的安全性和疗效。另一项2期临床试验评估了avalglucosidase alfa在既往接受α-葡萄糖苷酶治疗的婴儿期发作患者中的安全性和探索性疗效。两项临床试验的结果均在今年早些时候的医疗大会上公布。
参考资料:
[1] FDA grants priority review for avalglucosidase alfa, a potential new therapy for Pompe disease. Retrieved November 17, 2020, from https://www.globenewswire.com/news-release/2020/11/18/2128825/0/en/FDA-grants-priority-review-for-avalglucosidase-alfa-a-potential-new-therapy-for-Pompe-disease.html
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..