引言
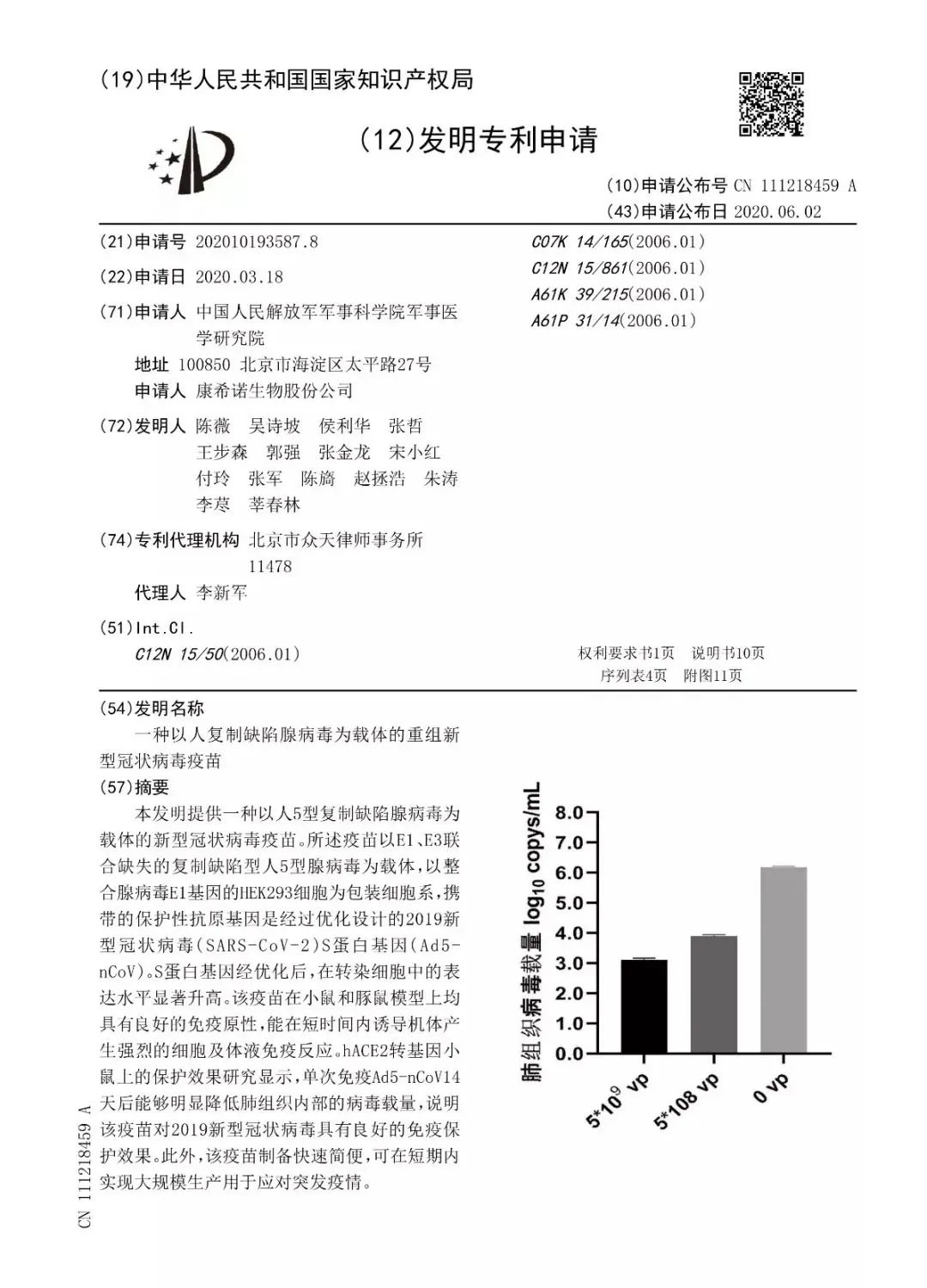
据国家知识产权局消息,由军科院军事医学研究院陈薇院士团队及康希诺生物联合申报的新冠疫苗专利申请,已被授予专利权,这是我国首个新冠疫苗专利。国家知识产权局的授予发明专利权通知书上,该项专利的名称是“一种以人复制缺陷腺病毒为载体的重组新型冠状病毒疫苗”。根据专利摘要,该发明提供一种以人5型复制缺陷腺病毒为载体的新型冠状病毒疫苗。该疫苗在小鼠和豚鼠模型上均具有良好的免疫原性,能在短时间内诱导机体产生强烈的细胞及体液免疫反应。此外,该疫苗制备快速简便,可在短期内实现大规模生产用于应对突发疫情。
专利申请获批的消息引发了社会的广泛关注。笔者从专业角度,对大家关心的几个问题进行解读。
问题1、通常情况下,疫苗上市是一个非常漫长的周期,往往要经历8到20年不等的时间。此次新冠疫苗专利获批速度超乎寻常,且国内目前不公开3期临床试验的数据。此次疫苗获批专利的充分合理性体现在哪?
答:一个专利申请是否应当授予专利权,其决定因素是发明专利申请的三大授权要件:是否属于专利权保护客体、说明书是否公开充分、是否具备三性。
一、是否属于专利权保护客体
该发明专利申请一共有14项权利要求,其中具有5项独立权利要求,分别要求保护的主题是:
1.一种编码2019新型冠状病毒S蛋白的多核苷酸;
2.一种含有权利要求1所述多核苷酸的载体;
4.一种能够表达权利要求1所述多核苷酸的人复制缺陷重组腺病毒;
6.权利要求4和5所述重组腺病毒在制备预防2019新型冠状病毒疫苗中的应用;
9.一种制备权利要求4或5所述的重组腺病毒的方法。
多核苷酸、载体、人复制缺陷重组腺病毒及其在制备疫苗中的用途和其制备方法均属于专利权保护客体。
二、说明书是否公开充分
该发明专利申请的说明书公开了“实施例1 .以人复制缺陷腺病毒为载体的重组新型冠状病毒疫苗的制备”、“实施例2 .不同构建重组腺病毒在小鼠模型上的免疫学评价”、“实施例3 .Ad5-nCoV在豚鼠模型上的免疫学评价”、“实施例4 .Ad5-nCoV在hACE2转基因小鼠模型上的保护效果评价”。按照《专利审查指南》的规定,药效实验数据可以是临床实验数据或者是动物实验数据,只要证明有相应的治疗预防效果即可,不是一定要等到临床实验数据出来才能申请专利。该发明专利申请的说明书已公开了相关动物实验数据,基本满足说明书公开充分的条件。
三、是否具备三性(新颖性、创造性和实用性)?
2019新型冠状病毒是新病毒,编码2019新型冠状病毒S蛋白的多核苷酸、载体、人复制缺陷重组腺病毒及其在制备疫苗中的用途和其制备方法,只要是之前没有公开过,就具备新颖性。该发明专利申请的主题涉及多核苷酸、载体、人复制缺陷重组腺病毒及其在制备疫苗中的用途和其制备方法,能够在产业上制造或者使用,并且能够产生积极效果,具备实用性。
是否具备创造性?创造性的要求比新颖性更高,除了要跟现有技术有区别,且该区别应具有突出的实质性特点和显着的进步, 这个其实在审查中具有一定的主观性。经检索发现,该专利申请进入实质审查后,申请人进行了主动补正,对权利要求书和说明书进行了修改,国家知识产权局没有发出审查意见通知书就直接授权了,这种情况还是很少的。
专利法第39条规定:发明专利申请经实质审查没有发现驳回理由的,由国务院专利行政部门作出授予发明专利权的决定,发给发明专利证书,同时予以登记和公告。发明专利权自公告之日起生效。还应说明的是,专利授权后,任何单位或者个人认为该专利权的授予不符合专利法有关规定,都可以根据专利法第45条的规定请求宣告该专利权无效。
问题2、新修订的《药品注册管理办法》对符合豁免药物临床试验条件的申请人作出了仿制药简化申请(ANDA)的规定;《药品管理法实施条例》中对于创新药数据保护期也给予了6年的期限,但公共利益需求等除外。这样来看,国内其他药企能否对其疫苗进行仿制?是否在合理的法律范围内?
答:首先,我们要解释一个概念。因为生物药往往是生物大分子,如多肽、蛋白等,这些大分子除了有氨基酸序列的排布外,通常还涉及空间结机构,仿制很难保证结构与原研完全一致,所以生物药的“仿制药”正规的称呼是:生物类似药。
我们再看看《药品管理法实施条例》中关于“数据保护期给予6年的期限,但公共利益需求等除外”的法条。具体是指第三十四条:国家对获得生产或者销售含有新型化学成份药品许可的生产者或者销售者提交的自行取得且未披露的试验数据和其他数据实施保护,任何人不得对该未披露的试验数据和其他数据进行不正当的商业利用。自药品生产者或者销售者获得生产、销售新型化学成份药品的许可证明文件之日起6年内,对其他申请人未经已获得许可的申请人同意,使用前款数据申请生产、销售新型化学成份药品许可的,药品监督管理部门不予许可;但是,其他申请人提交自行取得数据的除外。除下列情形外,药品监督管理部门不得披露本条第一款规定的数据:
(一)公共利益需要;
(二)已采取措施确保该类数据不会被不正当地进行商业利用。
综上,我们可以发现,新修订的《药品注册管理办法》中所指的仿制药仅限于化学药,生物制品(包括疫苗等生物药)不属于新修订的《药品注册管理办法》中的仿制药范畴。目前该发明专利申请已获授权,国内其他药企未经专利权人的许可,不得仿制该专利所涉疫苗。
问题3、根据国知局统计,我国发明专利平均审查周期是16.5个月,而陈薇院士团队及康希诺生物联合申报的新冠疫苗专利,申请日期为2020年3月18日,国家知识产权局发出专利授权通知书是2020年8月11日,仅用时不到半年,为什么获批速度会这么快?
答:因为新冠疫苗专利申请享受了优先审查政策。
根据《专利优先审查管理办法》第三条规定:“有下列情形之一的专利申请或者专利复审案件,可以请求优先审查:(一)涉及节能环保、新一代信息技术、生物、高端装备制造、新能源、新材料、新能源汽车、智能制造等国家重点发展产业;”,《办法》同时规定,发明专利申请应在45日内发出第一次审查意见通知书,并在一年内结案。
而2020年2月15日,由国家市场监管总局、国家药监局、国家知识产权局联合发布的《支持复工复产十条》,第三条规定:“对涉及仿制新冠肺炎的专利申请、商标注册,依请求予以优先审查办理。”则进一步加快了新冠疫苗专利的审批速度。
同时,国知局表示,对于所有与防治新冠肺炎疫情相关的专利申请,均会严格执行政策,公平公正地予以优先审查支持。
问题4、陈薇院士团队及康希诺生物联合申报的新冠疫苗专利,和此前武汉病毒研究所申报的“瑞德西韦抗2019新型冠状病毒的用途”专利,本质不同点是在哪里?
答:两者本质区别在于:武汉病毒研究所申报的“瑞德西韦抗2019新型冠状病毒的用途”专利是已知药物的第二用途专利,其保护范围相对较小,而且依赖性强(其实施依赖于吉利德的“瑞德西韦核心化合物“专利)。而陈薇院士团队及康希诺生物联合申报的新冠疫苗专利要求保护的是以人5型复制缺陷腺病毒为载体的新型冠状病毒疫苗,该专利保护范围较宽,不仅要求保护疫苗、还要求保护编码2019新型冠状病毒S蛋白的多核苷酸、载体、人复制缺陷重组腺病毒及其制备方法,是较为核心的专利,可以独立实施。
问题5、陈薇院士团队及康希诺生物联合申报的新冠疫苗专利,是否适用“药品专利的强制许可”这一制度?
答:《专利法》第四十九条规定:在国家出现紧急状态或者非常情况时,或者为了公共利益的目的,国务院专利行政部门可以给予实施发明专利或者实用新型专利的强制许可。第五十条:为了公共健康目的,对取得专利权的药品,国务院专利行政部门可以给予制造并将其出口到符合中华人民共和国参加的有关国际条约规定的国家或者地区的强制许可。可见,药品专利强制许可至少具备以下要件:
1、为了公共健康目的;
2、取得专利权;
3、药品。
陈薇院士团队及康希诺生物联合申报的新冠疫苗专利,满足以上第1、第2要件,但不符合第3要件,该新冠疫苗目前并不是可以商业化使用的药品,其疗效和毒副作用还有待临床试验数据的验证和确认,笔者我认为,在陈薇院士团队的新冠疫苗目前还在临床实验中,尚未获批上市的情况下去讨论和实施专利强制许可为时尚早。
我国虽然早在2009年就在专利法中增加了专利强制许可制度的相关内容,但是十余年来依然是“0实施”。其原因在于:我国作为知识产权大国,一直以来鼓励创新,对知识产权的保护也越来越重视,而专利强制许可制度归根结底,是对知识产权这种私有权的限制和挑战。所以在我国,强制许可制度的价值更多的是在于对滥用专利权的威慑和劝阻,而真正实施的可能性并不会很高。
备注:本文为原创文章,未经作者同意不得转载,作者联系方式:karen.wang@huiyelaw.com
文 | 汇业知识产权 汇业律师事务所合伙人 医谷特约撰稿人 王函 汇业律师事务所律师 王则周
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..