2019年是药品监管法律建设史上具有里程碑意义的一年,新制定的《疫苗管理法》是世界首部综合性疫苗管理法律,新修订的《药品管理法》是近20年来的一次全面修订,《疫苗管理法》《药品管理法》将党中央、国务院的部署,人民群众的期盼,审评制度改革的经验,以法律的形式固定下来,为巩固和推进药品审批审批制度改革提供了有力的法律保障。这一年,国家药品监督管理局药品审评中心(以下简称药审中心)在国家药品监督管理局(以下简称国家局)的坚强领导下,认真学习贯彻《药品管理法》《疫苗管理法》,持续推动药品审评审批制度改革,积极构建药品审评以流程为导向的科学管理体系,坚持依法依规、公开透明、服务为本、科学规范审评,切实保障药品安全有效可及,维护人民群众健康权益。
一、药品注册申请受理情况
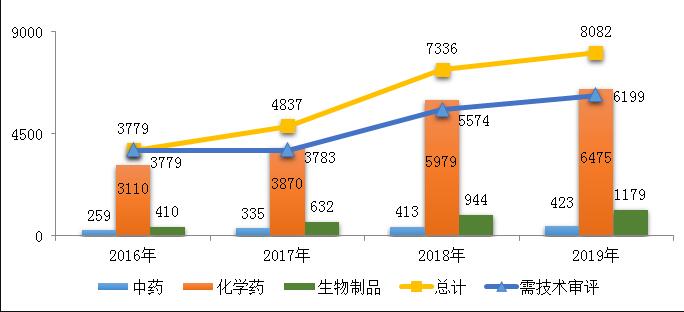
2019年,药审中心受理新注册申请8082件(含器械组合产品5件,以受理号计,下同),其中需技术审评的注册申请6199件(含4907件需药审中心技术审评和行政审批的注册申请),直接行政审批(无需技术审评,下同)的注册申请1878件。
(一)总体情况
药审中心受理的8077件药品注册申请中,化学药注册申请受理量为6475件,占2019年全部注册申请受理量的80.2%,2016-2019年各类药品注册申请受理情况详见图1。
图1 2016-2019年各类药品注册申请受理情况
注:1.2019年受理量中含5件器械组合产品的注册申请,故上图中2019年受理注册申请总量大于中药、化学药、生物制品受理注册申请之和;2. 药审中心的直接行政审批工作自2017年开始,所以2016年无直接行政审批注册申请,所有受理注册申请均需技术审评。
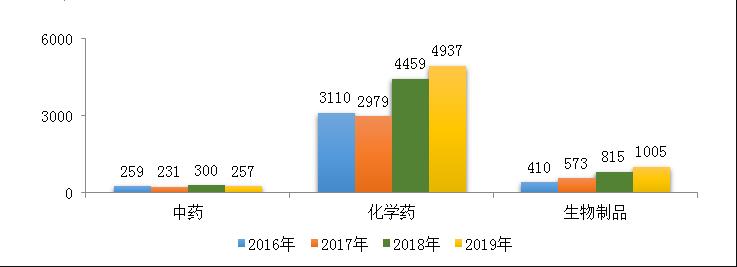
图2 2017-2019年需技术审评的各类药品注册申请受理情况
2019年,受理需技术审评的注册申请6199件,较2018年增加11.21%,其中化学药注册申请为4937件,较2018年增长了10.72%,占全部需技术审评的注册申请受理量的79.64%;中药注册申请257件,较2018年降低了14.33%;生物制品注册申请1005件,较2018年增长了23.3%。2016-2019年需技术审评的化学药、中药和生物制品注册申请受理情况详见图2。
药审中心受理1类创新药注册申请共700件(319个品种),(化学药的品种数以活性成分统计,中药和生物制品的品种数均以药品通用名称统计,下同),品种数较2018年增长了20.8%。其中,受理1类创新药的新药临床试验(IND)申请302个品种,较2018年增长了26.4%;受理1类创新药的新药上市申请(NDA)17个品种,较2018年减少了8个品种。
(二)国产创新药受理情况
药审中心受理国产1类创新药注册申请528件(244个品种),其中受理临床申请503件(228个品种),上市申请25件(16个品种)。按药品类型统计,化学药401件(144个品种),生物制品127件(100个品种),创新药的适应症主要集中在抗肿瘤、抗感染和消化系统疾病领域。
(三)进口创新药及原研药受理情况
药审中心受理5.1类化学药进口原研药注册申请157件(92个品种),受理1类进口创新药注册申请172件(75个品种),创新药的适应症主要集中在抗肿瘤、内分泌和神经系统疾病领域。
(四)各类注册申请受理情况
1.化学药注册申请受理情况
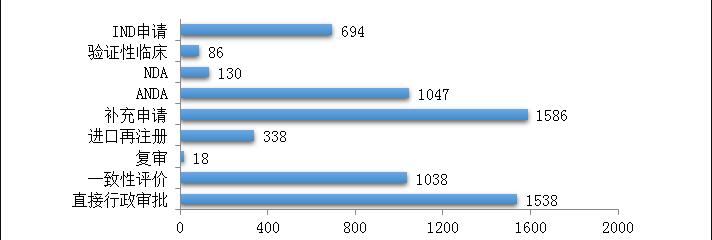
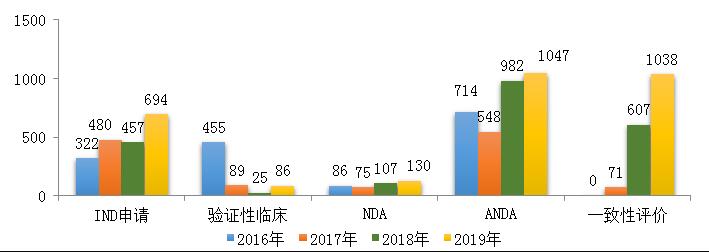
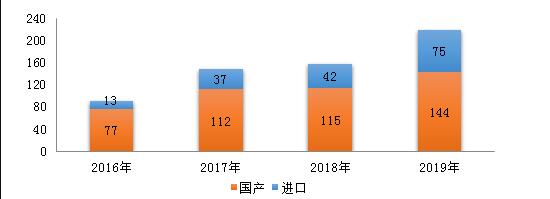
药审中心受理化学药注册申请6475件,其中受理化学药IND申请694件,较2018年增长了51.9%;受理化学药NDA 130件,较2018年增长了21.5%;受理仿制药上市申请(ANDA)1047件,较2018年增长了6.6%;受理一致性评价补充申请1038件(308个品种),件数较2018年增长71%。2019年化学药各类注册申请受理情况详见图3。2016-2019年化学药IND申请、NDA和一致性评价等注册申请受理情况详见图4。
图3 2019年化学药各类注册申请受理情况
图4 2016-2019年化学药IND申请、NDA和一致性评价等注册申请受理情况
注:药审中心自2017年8月开始承担仿制药质量和疗效一致性评价工作
(1)国产、进口化学药IND申请、NDA受理情况
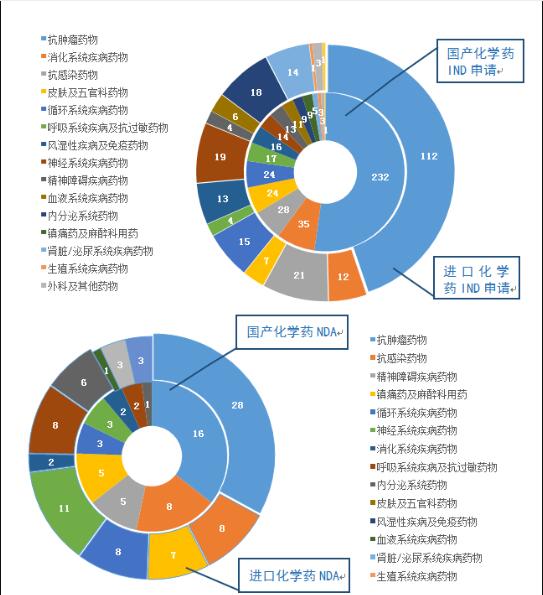
图5 2019年受理国产和进口的化学药IND申请、NDA治疗领域分布情况
在化学药IND申请中,受理国产化学药IND申请444件,受理进口IND申请250件。国产化学药IND申请的适应症主要集中在抗肿瘤、消化系统和抗感染药物领域,进口IND申请的适应症主要集中在抗肿瘤、抗感染药物和神经系统领域。
化学药NDA中,受理国产化学药NDA 45件,受理进口化学药NDA 85件。国产化学药NDA的适应症主要集中在抗肿瘤和抗感染药物领域,进口化学药NDA的适应症主要集中在抗肿瘤和神经系统领域。2019年受理国产和进口的化学药IND申请、NDA治疗领域分布情况详见图5。
(2)1类化学药创新药受理情况
药审中心受理1类化学药创新药注册申请573件(219个品种),品种数较2018年增加了39.5%,其中受理IND申请206个品种,较2018年增长了46.1%;受理NDA 13个品种,较2018年减少了3个。
图6 2016-2019年化学药创新药注册申请受理情况
219个品种的1类化学药创新药注册申请中,国产化学药创新药注册申请为144个品种,进口化学药创新药注册申请为75个品种。2016-2019年创新药注册申请受理情况详见图6。
2.中药注册申请受理情况
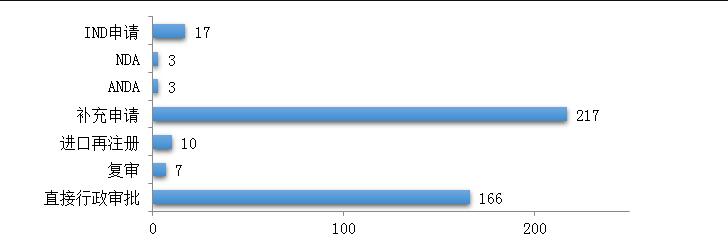
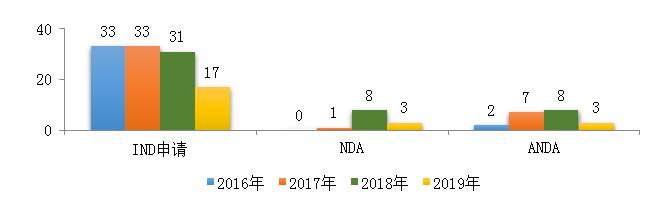
药审中心受理中药注册申请423件,其中受理中药IND申请17件,受理中药NDA 3件,受理中药ANDA 3件。2019年中药各类注册申请受理情况详见图7。2016-2019年中药IND申请、NDA和ANDA受理情况详见图8。
图7 2019年中药各类注册申请受理情况
图8 2016-2019年中药IND申请、NDA、ANDA受理情况
(1)中药IND申请受理情况
在17件中药IND申请(5、6、8类)中,适应症主要集中的治疗领域为消化、呼吸和骨科,占全部中药IND申请的76%。
(2)中药新药受理情况
药审中心受理5-6类中药新药注册申请18件(18个品种,无1-4类中药注册申请),其中中药IND申请15件(15个品种),中药NDA 3件(3个品种),较2018年均有所减少。
3.生物制品注册申请受理情况
图9 2019年生物制品各类注册申请受理情况
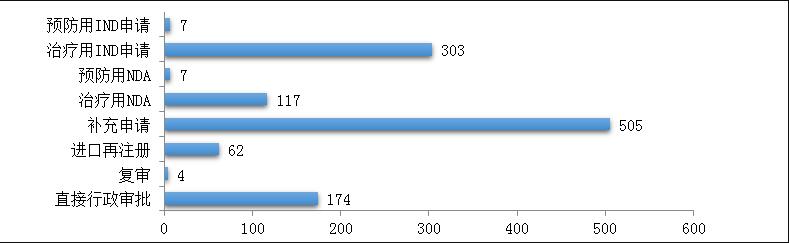
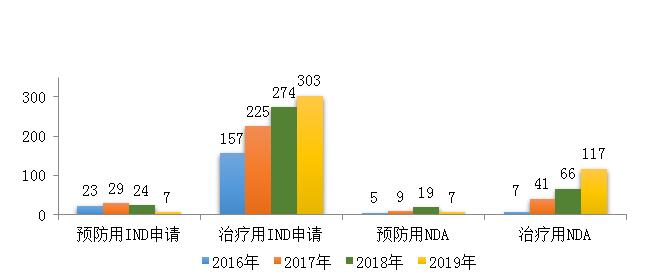
药审中心受理生物制品注册申请1179件,其中受理生物制品IND申请310件(预防用IND申请7件,治疗用IND申请303件),较2018年增长了4%;受理生物制品NDA 124件(预防用NDA 7件,治疗用NDA 117件),较2018年增长了45.9%。2019年生物制品各类注册申请受理情况详见图9。2016-2019年生物制品IND申请和NDA受理情况详见图10。
图10 2016-2019年生物制品IND申请和NDA受理情况
(1)I类生物制品创新药受理情况
药审中心受理1类生物制品创新药注册申请127件(100个品种),件数较2018年增长了3.3%,其中预防用生物制品2件,治疗用生物制品125件。1类生物制品创新药注册申请中,IND申请121件(96个品种),较2018年增长了8%;NDA 6件(4个品种,均为治疗用生物制品),较2018年减少了5件。
图11 2019年受理的1类治疗用生物制品IND申请治疗领域分布情况
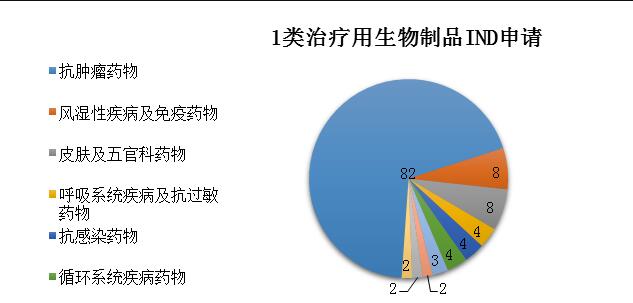
药审中心受理1类治疗用生物制品IND申请119件(95个品种),适应症主要集中在抗肿瘤治疗领域,占全部1类治疗用生物制品IND申请的69%,具体治疗领域分布详见图11。
二、药品注册申请审评审批情况
(一)总体完成情况
1.全年审评审批完成情况
2015年至2018年期间药审中心通过扩充审评通道、强化审评项目管理、大规模招聘人员、借调省局人员等措施多渠道扩增审评力量、提高审评效率,使得药品注册申请积压基本得以解决,药审中心的工作重点已经由解决药品注册申请积压逐渐过渡为提升药品注册申请的按时限审评审批率,2019年药审中心实现了中药、化学药、生物制品各类注册申请按时限审评审批率超过90%,基本完成了国务院《关于改革药品
医疗器械审评审批制度的意见》(国发〔2015〕44号,以下简称44号文件)确定2018年实现按规定时限审批的工作目标。
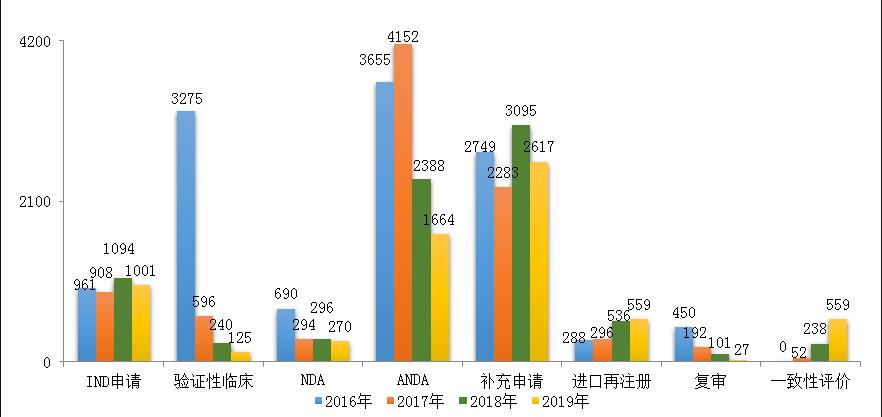
2019年完成审评审批的注册申请共8730件(含器械组合产品5件),其中完成需技术审评的注册申请6817件(含4075件需药审中心技术审评和行政审批注册申请),完成直接行政审批的注册申请1908件。2019年底在审评审批和等待审评审批的注册申请已由2015年9月高峰时的近22000件降至4423件(不含完成审评因申报资料缺陷等待申请人回复补充资料的注册申请),巩固了44号文件要求解决注册申请积压的改革成效。
2019年4423件在审评审批和等待审评审批的注册申请中,启动审评3334件,审评结束等待核查450件,处于暂停审评计时等待关联品种(290件)、等待申请人核对质标说明书包装标签工艺(235件)、等待检验报告(36件)等情况中的任务共639件。
完成技术审评的6817件注册申请中,中药注册申请300件,生物制品注册申请1104件,化学药注册申请为5413件,化学药注册申请约占全部审评完成量的79%。
2.各类注册申请审评完成情况
图12 2016-2019年各类注册申请审评完成情况
注:2019年含5件器械组合产品的注册申请,故上图中2019年注册申请总量大于中药、化学药、生物制品注册申请之和。
药审中心完成IND申请审评1001件(含1件器械组合产品),完成NDA审评270件(含1件器械组合产品),完成ANDA审评1664件(含3件药械组合产品)。2016-2019年各类注册申请审评完成情况详见图12。
3.审评通过情况
2019年,药审中心审评通过批准IND申请926件,审评通过NDA 164件,审评通过ANDA 654件,审评通过批准口服固体制剂一致性评价申请260件(按活性成分统计95个品种,按通用名统计107个品种,详见附表1),品种数较2018年(57个品种)同比增长66.7%。
审评通过上市1类创新药10个品种,审评通过进口原研药58个品种(含新适应症),具体品种详见附表2、3。
(二)化学药注册申请审评完成情况
1.总体情况
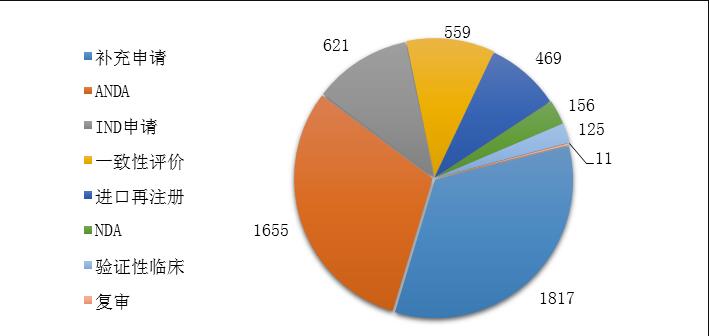
图13 2019年化学药各类注申请的审评完成情况
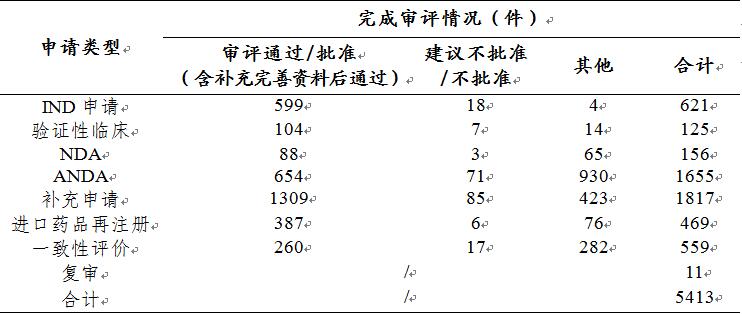
药审中心完成审评的化学药注册申请5413件,其中完成化学药临床申请(IND申请和验证性临床)共746件,完成化学药NDA 156件,完成化学药ANDA 1655件。2019年化学药各类注册申请的审评完成情况详见图13。
2.审评通过情况
图14 2016-2019年化学药NDA审评通过数量情况
表1 2019年化学药各类注册申请审评完成的具体情况
注:“其他”是指申请人主动申请撤回的注册申请、完成审评等待申请人补充完善申报资料的注册申请、非药审中心审评报送国家局药品注册管理司的注册申请、送国家局医疗器械技术审评中心的药械组合注册申请和关联制剂撤回的原料/辅料注册申请等,下同。
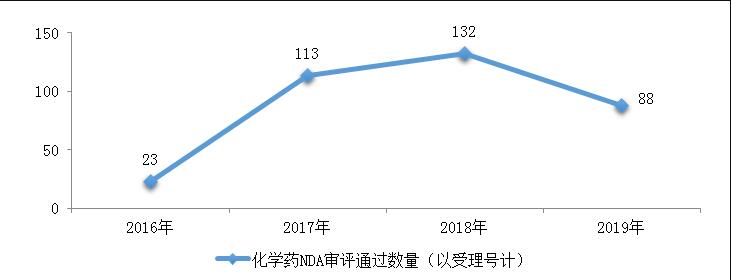
药审中心完成审评的化学药NDA共156件,其中审评通过88件。2016-2019年化学药NDA审评通过数量情况详见图14,2019年化学药各类注册申请审评完成的具体情况详见表1。
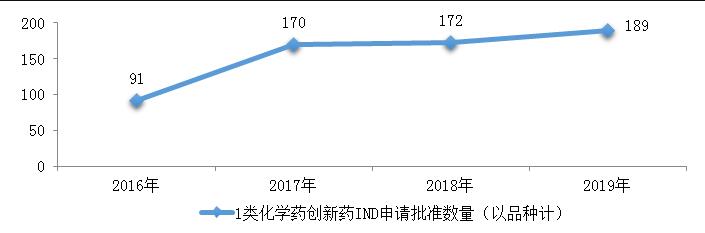
药审中心完成审评的化学药IND申请621件,审评通过批准IND申请599件,其中批准1类化学药创新药IND申请493件(189个品种)。2016-2019年1类化学药创新药IND申请审评通过批准数量详见图15。
图15 2016-2019年1类化学药创新药IND申请批准数量
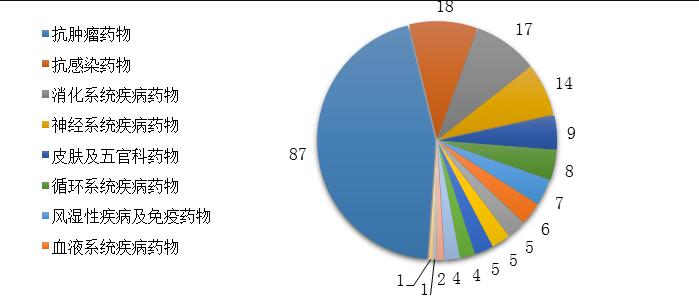
药审中心批准IND申请的189个1类化学药创新药中,抗肿瘤药物、消化系统疾病药物、抗感染药物和神经系统疾病药物较多,占全部创新药临床试验批准数量的70%。2019年审评审批IND申请的1类化学药创新药适应症分布详见图16。
图16 2019年审评审批IND申请的1类化学药创新药适应症分布
注:部分化学药创新药有多个适应症分布在不同的适应症分组中,故上图中各适应症分组创新药品种数之和大于189个。
(三)中药注册申请审评完成情况
1.总体情况
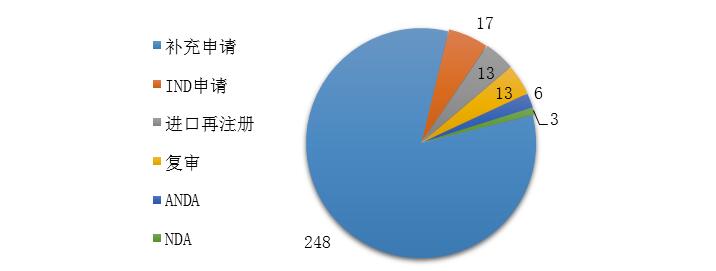
药审中心完成审评的中药注册申请300件,其中完成IND申请17件,完成NDA 3件,完成ANDA 6件。2019年中药各类注册申请的审评完成情况详见图17。
图17 2019年中药各类注册申请的审评完成情况
2.审评通过情况
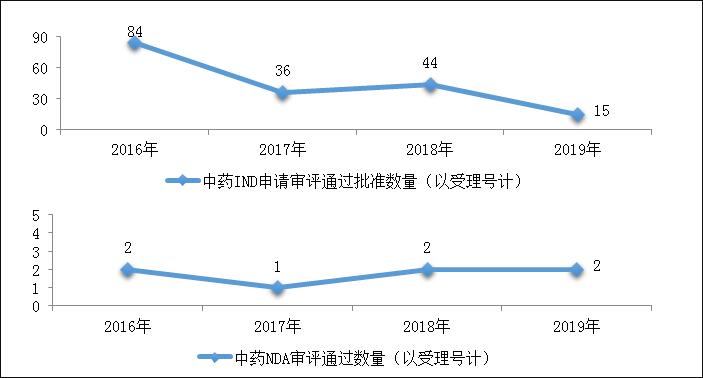
图18 2016-2019年中药IND申请审评通过批准和NDA审评通过数量
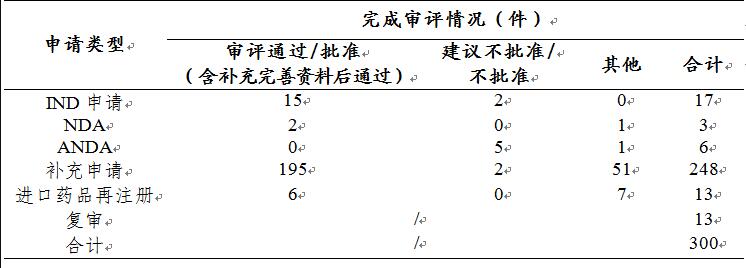
药审中心审评通过批准中药IND申请15件,审评通过中药NDA 2件(2个品种,芍麻止痉颗粒、小儿荆杏止咳颗粒)。2019年中药各类注册申请审评完成的具体情况详见表2,2016-2019年中药IND申请审评通过批准和NDA审评通过数量详见图18。
表2 2019年中药各类注册申请审评完成的具体情况
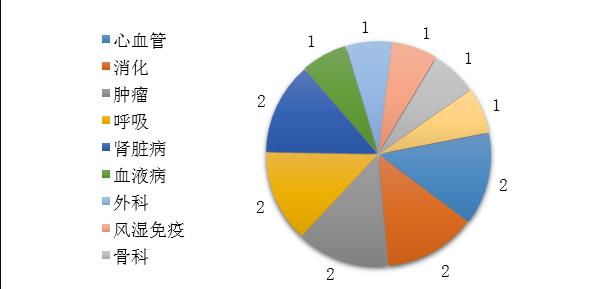
药审中心审评通过批准的中药IND申请15件,涉及10个适应症领域,其中心血管、消化、肿瘤、呼吸、肾脏各2件,共占67%,具体治疗领域分布详见图19。
图19 2019年批准IND申请的中药适应症分布
(四)生物制品注册申请审评完成情况
1.总体情况
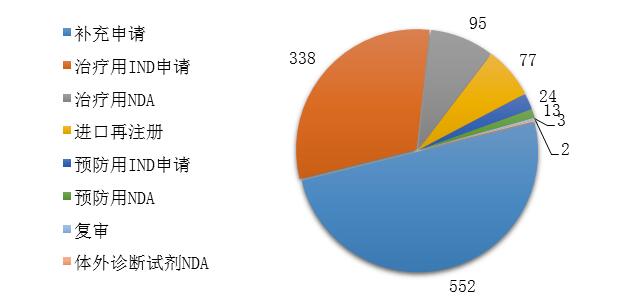
药审中心完成审评的生物制品注册申请共1104件,其中完成预防用生物制品IND申请(预防用IND申请)24件,完成治疗用生物制品IND申请(治疗用IND申请)338件,完成预防用生物制品NDA(预防用NDA)13件,完成治疗用生物制品NDA(治疗用NDA)95件,完成体外诊断试剂NDA(体外诊断NDA)2件。2019年生物制品各类注册申请的审评完成情况详见图20。
图20 2019年生物制品各类注册申请的审评完成情况
2.审评通过情况
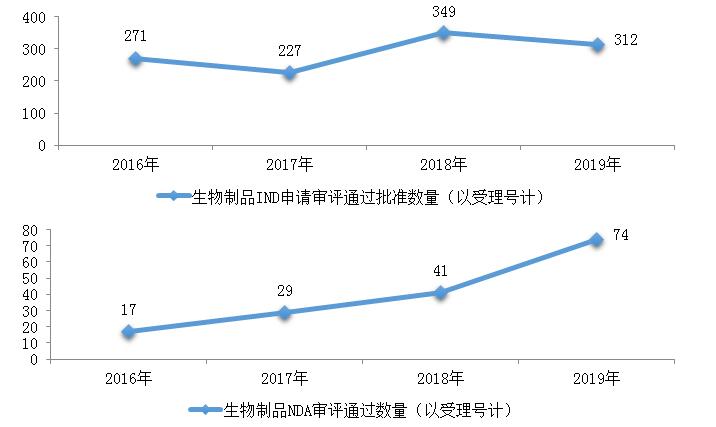
药审中心审评通过批准预防用IND申请18件、治疗用IND申请294件,审评通过预防用NDA 5件、治疗用NDA 67件、体外诊断NDA 2件。2019年生物制品各类注册申请审评完成的具体情况详见表3,2016-2019生物制品IND申请审评通过批准和NDA审评通过数量详见图21。
表3 2019年生物制品各类注册申请审评完成的具体情况
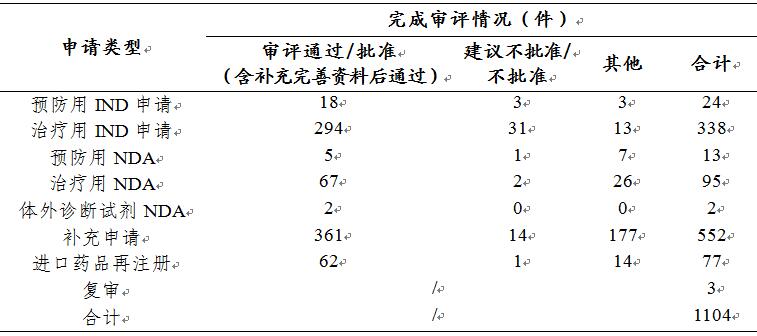
图21 2016-2019年生物制品IND申请审评通过批准和NDA审评通过数量
药审中心审评通过批准生物制品IND申请312件,治疗领域分布详见图22。