作者:王雪1,2,刘丽华2,张绮1,张林琦1,王涛2*
王雪1,2,刘丽华2,张绮1,张林琦1,王涛2*
1清华大学医学院药品监管科学研究中心,北京100084
2国家药品监督管理局药品审评中心,北京100022
摘要
罕见病是一类单病种患病率极低的疾病,其治疗药物的研发需要政府的扶持。美国政府于1983年率先颁布《孤儿药法案》,并且建立了相应的管理模式及政策法规,随后许多国家和地区纷纷借鉴和建立了美国罕见病治疗药物的政策。本文基于分析美国罕见病治疗药物政策发展获得的成果及遇到的问题,为我国罕见病治疗药物研发创新和可及性政策制定提供思路与参考。
关键词:罕见病治疗药物、孤儿药、政策激励、启示
作者简介:王雪(1989.4-)女,博士,主要从事药品监管政策研究
通讯作者:王涛,主任药师,首席审评员,Tel:(010)68921305E-mail:wangtao@cde.org.cn
AnalysisofrarediseasedrugincentivepoliciesinUnitedStatesanditsinspirationtoChina
WANGXue1,2,LIULi-hua2,ZHANGQi1,ZHANGLin-qi1,WANGTao2*
1ResearchCenterofDrugRegulationScience,SchoolofMedicine,TsinghuaUniversity,Beijing100084,China
2CenterofDrugEvaluation,NationalMedicalProductsAdministration,Beijing100022,China
AbstractRarediseasesareaclassofdiseaseswithextremelylowprevalence.Thedrugdevelopmentforrarediseaserequiresgovernmentsupport.TheUnitedStatesfirstenactedthe"OrphanDrugsAct"in1983,andestablishedcorrespondingmanagementmodels,policiesandregulations.Manycountriesandregionshavesubsequentlylearnedfromthosepoliciesofrarediseasedrugsandestablishedtheirownpolicies.ThisarticleanalyzestheachievementsandproblemsintherarediseasedrugspolicyintheUnitedStates,andprovidesadvicetopolicymakersforrarediseasedrugdevelopmentinChina.
Keywords:rarediseasedrugs,orphandrugs,policyincentives,inspiration
罕见病是指单病种患病率极低的一类疾病。由于罕见疾病单病种发病率低、发病机制复杂等特点,罕见疾病治疗药物的研发较为困难且市场回报较小,因此,罕见疾病治疗和药物的研发离不开政府的政策激励[1]。美国1983年颁布了《孤儿药法案》(“OrphanDrugAct”)后[2],补文献,极大的推动了罕见病与孤儿药的研究,为各国罕见病治疗药物政策的研究奠定了一定的基础[3]。本文通过分析美国FDA历史发布的罕见疾病治疗药物法律法规及政策变迁及近年美国FDA孤儿药批准情况,提出完善我国罕见疾病治疗药物相关政策的建议。
1、FDA罕见病治疗药物政策历史及近年批准的孤儿药分析
1.1罕见病及孤儿药的激励政策及法规
1983年1月,美国国会颁布了《孤儿药法案》[2],补文献法案规定罕见病治疗药物在通过孤儿药资格认定后,可享受减免申请费用及企业税收、协助研究方案制定、7年市场独占、有条件批准、专项研发基金资助等激励政策;1992年FDA发布了《孤儿药法案实施办法》“orphandrugregulation”)[4],补文献并于2013年6月再次修订后发布,该实施办法为《孤儿药法案》明确了具体执行方法;2002年12月,美国国会颁布了《罕见病法案》(“RareDiseasesActof2002”)[5],为罕见病研究提供了具体法律保障,并且增加了其研究基金。
此外,为确保及时审查孤儿药认定请求,节省孤儿药开发的时间,FDA对孤儿要认定计划进行了全面的现代化改造,于2017年6月发布了《孤儿药现代化计划》(“FDA’sOrphanDrugModernizationPlan”)[6],补文献该计划提出90天内对超过120天的所有请求进行完整审核,90天后,对所有提出新的孤儿药认定在90天内给予回复。并且,成立“孤儿药产品委员会”,通过改善组织结构与流程,解决与孤儿药相关的科学监管问题,让孤儿药认定过程有了效率上的保障。
1983年前,美国上市的孤儿药的只有38种,1983年《孤儿药法案》颁布后至今,美国FDA已有500多种孤儿药被批准上市[7]。由此可见,罕见病与孤儿药的推动离不开政府政策激励。近五年,孤儿药的研发热度不减(图1),尤其在刚刚过去的2018年孤儿药批准数目以及占比均创下历史新高,占批准全部新药的57.6%[8-12]。
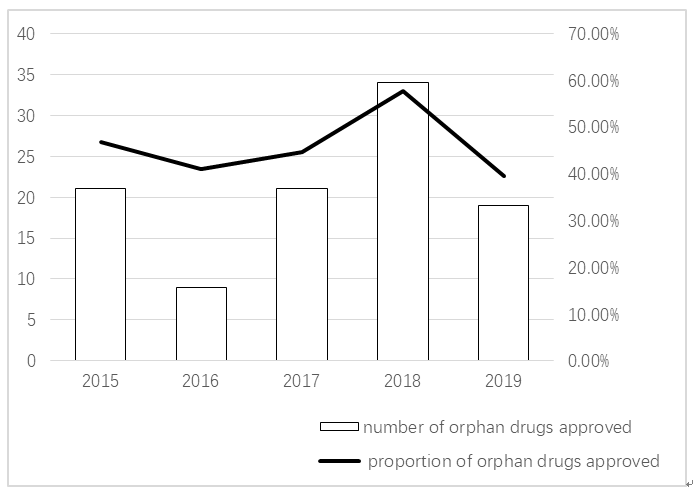
图12015至今FDA批准孤儿药的数量和所占新药比例
Figure1ThenumberandproportionoforphandrugsapprovedbyFDAin2015todate
1.2罕见疾病政策中的儿童用药政策
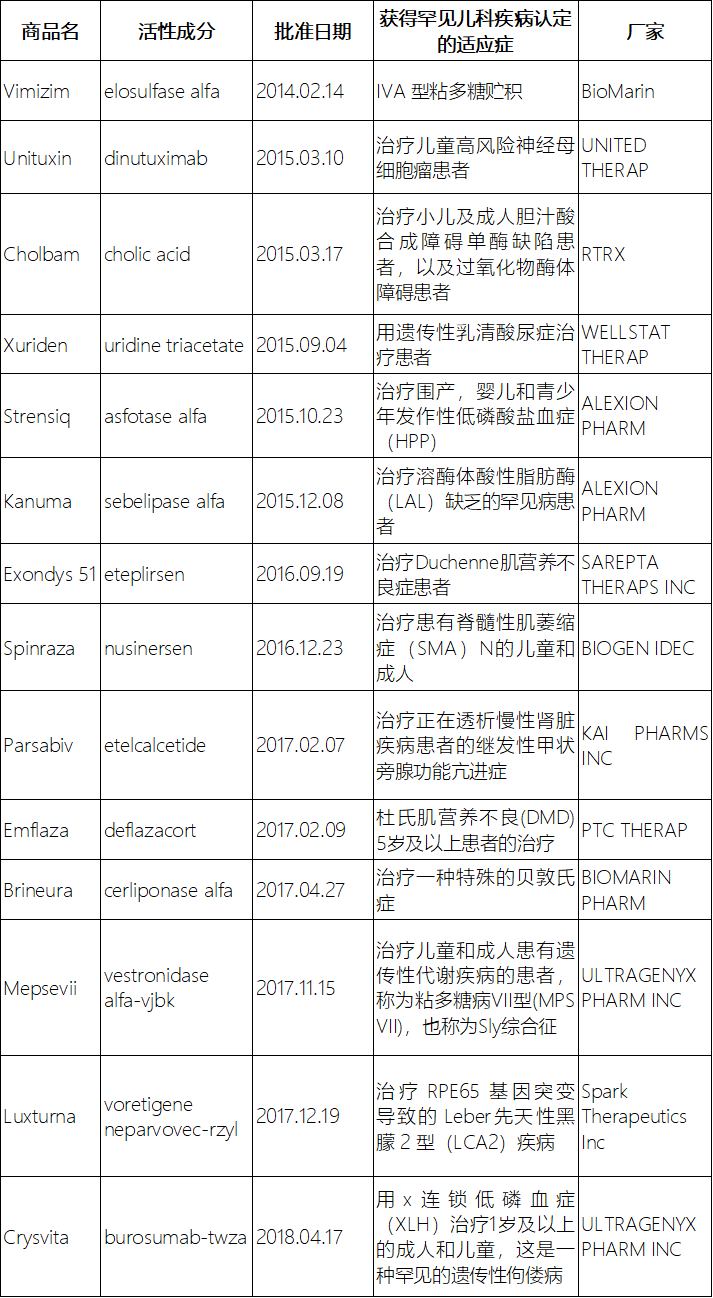
儿童用药缺乏已经成为困扰全球儿童用药的问题,儿科人群药物临床试验的难度远远大于成人。为了鼓励儿科疾病的研究,在孤儿药认定中允许对常见疾病的儿科亚群进行孤儿药认定。从而,鼓励罕见儿科疾病用药的研发[13]。2012年7月,美国国会颁布的《食品药品安全与创新法案》[14]补文献(“FoodandDrugAdministrationSafetyandInnovationAct”)中首次提出了“罕见儿科疾病优先审评券激励计划”(“RarePediatricDiseasePriorityReviewVoucherIncentiveProgram”)[14],补文献并于2014年11月FDA发布了《罕见儿科疾病优先审查券行业指南》(“RarePediatricDiseasePriorityReviewVouchersGuidanceforIndustry”,2019年7月再次修订)[15],该指南解释了FDA计划如何实施FD&CActSection529。截至今日,FDA总共发出14张审评优惠券(表1)[8-12]。其中,2015年和2017年均发出5张罕见儿科疾病优先审评券。
表1获得罕见儿科疾病优先审评券的产品信息
Table1productinformationofrarepediatricpriorityreviewvouchers
2、罕见病治疗药物政策遇到的问题
2.1靶向药物通过缩小适应症范围获得孤儿药资格
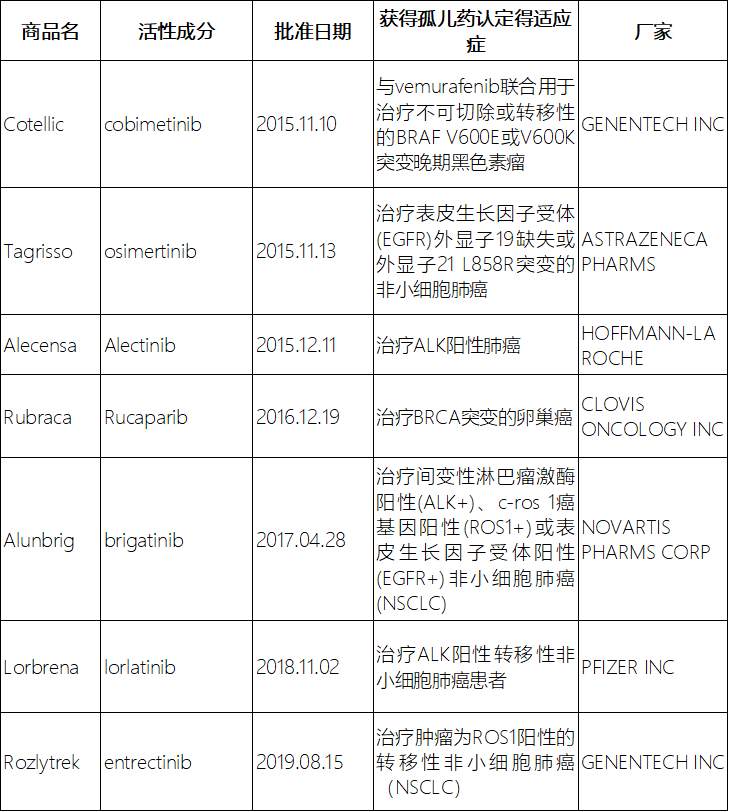
孤儿药的激励政策惠及了许多罕见疾病,为罕见病患者带去福音,但也有被滥用的争议。其中,最为明显的滥用争议是某些并不是罕见疾病的癌症,靶标药物通过以特定的生物标记,例如EGFR、ALK阳性等,将适应症范围缩小至某些癌症的亚型,从而通过孤儿药的认定,获得孤儿药相应的激励政策。近5年就有7个获得孤儿药认定的用于治疗某些基因突变的常见癌症(表2)[8-12]。
表2 2015-2019年批准治疗特定分子标记的癌症亚群的孤儿药信息
Table2Orphandrugapprovedinformationoftreatmentofspecificmolecularlylabeledcancersubpopulationsin2015-2019
2.2孤儿药的市场回报不“孤儿”
《孤儿药法案》为通过孤儿药认定的罕见疾病治疗药物提供了7年的市场独占期,以此保证研发者能收回研发成本获得相应的利润。实际上,有许多拥有孤儿药资格的药品的销售额并不“孤儿”。
前文提到的近五年通过特殊的分子标记来缩小适应症范围获得孤儿药资格的7种药物中,就有部分孤儿药的市场回报很高,近三年的全球销量逐渐上升,其中Osimertinib和Alectinib的2018年销量分别达到了15.5亿美元和5.8亿美元(表3)。2017年12月,美国国会众议院发布消息,将孤儿药激励政策中的税收减免额度从原先的用于孤儿药研发临床费用的50%下调至25%[16]。
表32015-2019年批准治疗特定分子标记的癌症亚群的孤儿药全球销量(亿美元)
Table3Globalsalesoforphandrugsapprovedin2015-2019fortreatmentofspecificmolecularlylabeledcancer subpopulations(billionsofdollars)
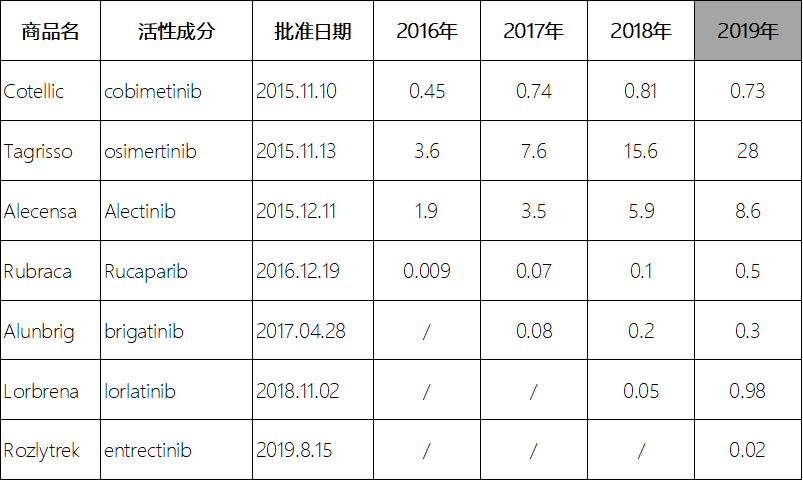
注:数据来源于IMS数据库
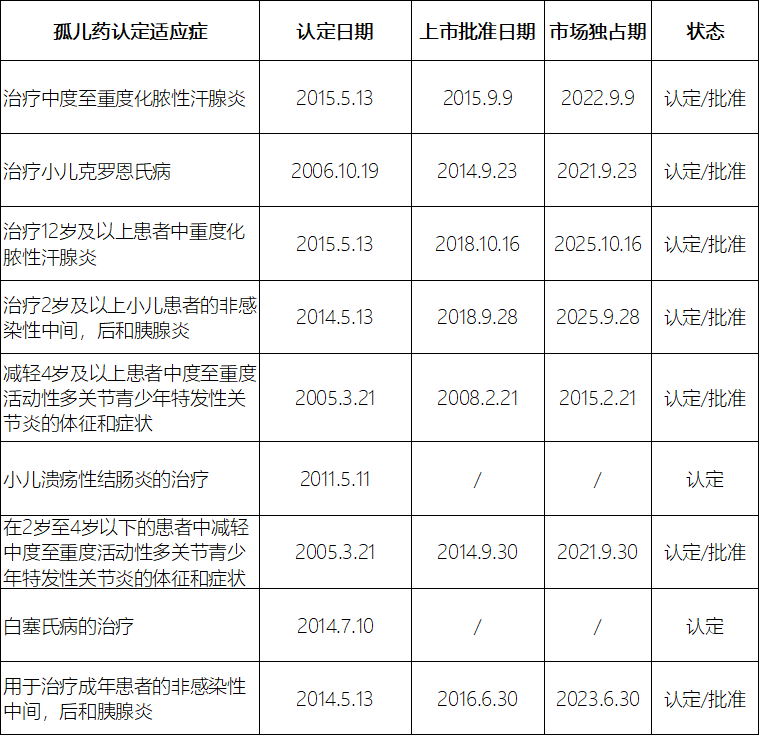
此外,由于孤儿药认定时间不仅限于新药研发阶段,在药品全生命周期都可以进行孤儿药认定。有些已经上市的药品依然可以通过开发新的适应症来进行孤儿药认定,以此享受孤儿药的激励政策,这些药品通常已经具有很大的市场。例如,用于诸多自体免疫疾病的阿达木单抗Adalimumab,其2016年、2017年、2018年的全球销量分别是189.6亿美元、223.1亿美元、249.4亿美元(数据来源于IMS数据库)。在FDA孤儿药认定与批准网页上输入“adalimumab”查询,查询结果可见阿达木单抗自2002年6月30日FDA批准上市以来进行了9次不同适应症的孤儿药认定(见表4),其中7个适应症被批准上市,享受孤儿药相应的激励政策,5个适应症还在市场独占保护期内。
表4 阿达木单抗不同适应症的孤儿药认定信息
Table4Orphandrugdesignationinformationofadalimumabindifferentindications
2.3儿科罕见疾病政策的滥用
为了鼓励儿童用药的发展,2003年颁布《儿科研究平安法》(“PediatricResearchEquityAct”,PREA)明确要求在药品及生物制品上市前必须开展其儿科临床研究[18]。然而,长期以来,孤儿药认定中允许授予常见疾病中以儿童族群为目标适应症的新药,获得孤儿药资格新药或以儿童族群为适应症标的获得孤儿药资格,则无需进行以儿童族群为研究对象的临床试验,可豁免PREA的要求,与PREA相违背。2018年7月,FDA发布了《常见病儿科亚群孤儿药认定说明》(“ClarificationofOrphanDesignationofDrugsandBiologicsforPediatricSubpopulationsofCommonDiseases”),说明中指出由于儿科亚群认定与《儿科研究平安法》(“PediatricResearchEquityAct”)豁免条件有些法规漏洞,因此FDA宣布将不会再对常见疾病的儿科亚群药物给予任何额外的孤儿药认定[19]。另外,在2016年9月颁布的《推进希望法案》(“AdvancingHopeActof2016”)修改了罕见儿科疾病的定义,将罕见儿科疾病的定义加上了“严重的或者威胁生命的”的限定词,以鼓励真正急需用药的罕见小儿疾病的研发[20]。
3、我国罕见病与孤儿药现状及发展方向
根据国务院印发的《“十三五”国家药品安全规划》中提到“及时出台政策,优先审评审批部分临床急需的仿制药,加快审评审批对重大疾病、罕见病、老年人和儿童疾病有更好疗效的创新药及医疗器械”,现阶段急需出台相关政策,激励企业进行孤儿药的研发,解决罕见病人群用药的需求问题。目前,我国已于2018年发布了《第一批罕见病目录》,公布了包括21-羟化酶缺乏症等在内的121中罕见病,但尚缺乏专门的孤儿药立法、管理规定及实施办法[1]。当务之急,我国罕见病和孤儿药政策可借鉴美国等发达国家经验,结合我国现阶段实际情况,制定出符合我国国情的相关政策。
3.1制定激励我国孤儿药研发的相关政策
根据FDA的经验,罕见疾病及孤儿药的发展离不开政府的激励政策。首先,应制定符合我国现阶段国情的罕见病及孤儿药资格认定机制。随后,明确政府激励政策。例如,减免申请费用、根据孤儿药研发投入情况减免企业税收、审评部门协助孤儿药研究方案制定、对上市的孤儿药提供市场独占保护期、科技部门建立专项研发基金资助、开通审评快速通道等。由于我国研发创新药的能力不及欧美日等发达国家,对于临床急需的罕见病用药可以参考FDA的“罕见儿科疾病优先审评券激励计划”,给予创新型的孤儿药“优先审评券”。
3.2解决已有孤儿药的可及性问题
由于创新药的研发周期长,成功率低等特点。解决罕见疾病用药难问题,首要是如何获取已有的罕见疾病治疗药物。可以从两个方面入手。首先,通过加速审评等政策,加快国外已上市孤儿药的进口。其次,参考部分孤儿药研发激励政策,鼓励我国药企仿制国外已有的孤儿药。
4、讨论
纵观美国FDA罕见疾病及孤儿药政策法规的发展历程和取得的成效,不仅推动了罕见疾病治疗药物的研发,也带动了新药创新体系的建设和制药工业的发展,同时为欧盟、日本、新加披等发达地区的罕见疾病治疗药物政策奠定了基础。我国罕见病和孤儿药没有清晰的管理体系,可以借鉴发达国家经验,结合中国药物研发实际,完善我国罕见病用药(或孤儿药)审评与管理制度,促进针对罕见病的药物研发。同时,在制定罕见疾病和孤儿药相关的政策法规时,应考虑我国国情,以及将如何规避法规漏洞纳入考虑范围,让我国的孤儿药政策真正运用在临床急需的罕见疾病上。
参考文献
[1]刘丽华,赵建中,谢松梅,等.罕见病药物的临床审评:挑战与思考[J].国际药学研究杂志,2019,46(9):673-678.
[2]U.S.FOODANDDRUGADMINISTRATION.Orphandrugact[EB/OL].SilverSpring:U.S.FoodAndDrugAdministration.1983-1-4[2020-1-9].https://www.fda.gov/industry/designating-orphan-product-drugs-and-biological-products/orphan-drug-act-relevant-excerpts
[3]易八贤,王广平,姬海红,等.美国孤儿药法案30年历程与我国新药创新制度体系完善[J].中国新药杂志,2014,23(10):1107-1114.
[4]U.S.FOODANDDRUGADMINISTRATION.OrphanDrugRegulations[EB/OL].SilverSpring:U.S.FoodAndDrugAdministration.2013-6-12[2020-1-9].https://www.govinfo.gov/content/pkg/FR-2013-06-12/pdf/2013-13930.pdf
[5]NIH.Rarediseasesactof2002.[EB/OL].2002-12-6[2020-1-9].Bethesda:NIH.https://history.nih.gov/research/downloads/PL107-280.pdf
[6]U.S.FOODANDDRUGADMINISTRATION.FDA’sorphandrugmodernizationplan[EB/OL].SilverSpring:U.S.FoodAndDrugAdministration.2017-6-29[2020-1-9].https://www.fda.gov/media/106012/download
[7]MarleneE.Haffner,HaffnerAssociates.Thehistoryoforphandrugregulation-USandbeyond[J].ClinPharmacolTher.2016,100(4):342-3.
[8]U.S.FOODANDDRUGADMINISTRATION.NovelDrugApprovalsfor2015[EB/OL].SilverSpring:U.S.FoodAndDrugAdministration.2016-2-5[2020-1-10].https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2015
[9]U.S.FOODANDDRUGADMINISTRATION.NovelDrugApprovalsfor2016[EB/OL].SilverSpring:U.S.FoodAndDrugAdministration.2017-1[2020-1-9].https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2016
[10]U.S.FOODANDDRUGADMINISTRATION.NovelDrugApprovalsfor2017[EB/OL].SilverSpring:U.S.FoodAndDrugAdministration.2018-1[2020-1-9].https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2017
[11]U.S.FOODANDDRUGADMINISTRATION.NovelDrugApprovalsfor2018[EB/OL].SilverSpring:U.S.FoodAndDrugAdministration.2019-1[2020-1-11].https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2018
[12]U.S.FOODANDDRUGADMINISTRATION.NovelDrugApprovalsfor2019[EB/OL].SilverSpring:U.S.FoodAndDrugAdministration.2020-1-14[2020-1-17].https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2019
[13]潘家梅,张象麟.美国激励研制罕见儿科疾病药品的"优先审评券计划"制度概述[J].中国药事,2019(33)1:50-55.
[14]U.S.FOODANDDRUGADMINISTRATION.FoodandDrugAdministrationSafetyandInnovationAct[EB/OL].SilverSpring:U.S.FoodAndDrugAdministration.2012-7-9[2020-1-9].https://www.govinfo.gov/content/pkg/PLAW-112publ144/pdf/PLAW-112publ144.pdf
[15]U.S.FOODANDDRUGADMINISTRATION.RarePediatricDiseasePriorityReviewVouchersGuidanceforIndustry[EB/OL].SilverSpring:U.S.FoodAndDrugAdministration.2019-7[2020-1-9].https://www.fda.gov/regulatory-information/search-fda-guidance-documents/rare-pediatric-disease-priority-review-vouchers
[16]ScienceMag.Researcherswinsome,losesomeinfinalU.S.taxbill[EB/OL].2017-12-18[2020-1-11].https://www.sciencemag.org/news/2017/12/researchers-win-some-lose-some-final-us-tax-bill
[17]U.S.FOODANDDRUGADMINISTRATION.SearchOrphanDrugDesignationsandApprovals[EB/OL].SilverSpring:U.S.FoodAndDrugAdministration.https://www.accessdata.fda.gov/scripts/opdlisting/oopd/
[18]U.S.FOODANDDRUGADMINISTRATION.PediatricResearchEquityAct(PREA)[EB/OL].SilverSpring:U.S.FoodAndDrugAdministration.2003-12-3[2020-1-9]https://www.congress.gov/108/plaws/publ155/PLAW-108publ155.pdf
[19]U.S.FOODANDDRUGADMINISTRATION.ClarificationofOrphanDesignationofDrugsandBiologicsforPediatricSubpopulationsofCommonDiseasesGuidanceforIndustry[EB/OL].SilverSpring:U.S.FoodAndDrugAdministration.2018-7[2020-1-9].https://www.fda.gov/media/109496/download
[20]U.S.FOODANDDRUGADMINISTRATION.AdvancingHopeActof2016[EB/OL].SilverSpring:U.S.FoodAndDrugAdministration.2016-9-29[2020-1-9].https://www.congress.gov/114/plaws/publ229/PLAW-114publ229.pdf
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..