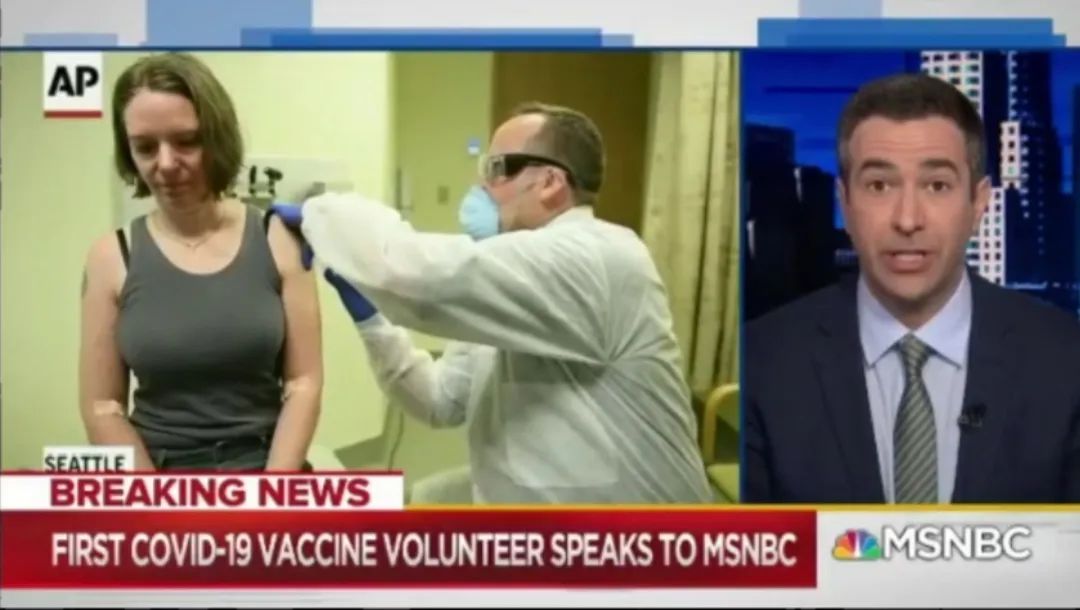
“成为第一个受试者我很兴奋,这很疯狂!”当地时间3月16日,43岁的健康志愿者Jennifer Haller在西雅图成为了美国第一个接受试验中的新冠疫苗注射的受试者,或许也是全球第一位。
美国国家过敏和传染病研究所(NIAID)主任Anthony Fauci在声明中称这是一项速度创下纪录的临床试验,原先预计全球进行新冠疫苗人体试验最早也是在四月。上述疫苗试验的超前进度主要得益于NIAID允许将其快速导入人体试验阶段,而无需在动物模型中进行全面测试。但这一环节的省略,在国内外引起了争议。
这一试验疫苗是由NIAID科学家与生物技术公司Moderna共同开发的。而今天,来自中国的生物科技公司—康希诺也发布公告称,重组新冠病毒疫苗递交新药临床试验预审申请,并将启动志愿者预招募。
目前,Moderna的疫苗研发进度早先中国一步。最新消息显示,昨天(3月16日)陈薇院士团队研制的重组新冠疫苗获批启动展开临床试验。
01.更多试验细节披露
尽管进入人体试验可以使疫苗更快地推向市场,但这只是第一步。
药物或疫苗在被视为安全有效且被广泛使用之前,一般需要经过三期临床试验。本次健康受试者的试验仅为第一阶段。美国临床试验数据库显示,本次试验除了监测副作用外,研究人员还将通过分析志愿者血液中的抗体来测试疫苗是否触发免疫反应。
在接下来的六周中,研究人员计划招募45名年龄在18至55岁之间的健康成年人,这45名志愿者将接受不同剂量的新疫苗(称为mRNA-1273),并将在14个月的时间内接受监测,以测试疫苗的安全性以及在志愿者体内诱导免疫反应的能力,这一试验将在华盛顿州的西雅图展开。
根据NIAID声明,志愿者将在上臂接受两次疫苗注射,两剂之间的间隔为28天。第一位参与者将获得最低剂量的疫苗,即每次接种25微克。此外还有三名也接受了相同的初始剂量,另外四名将在周二接受100微克剂量的疫苗接种。
NIAID疫苗研究中心副主任Barney Graham博士表示,在更多的受试者接受注射之前,会留有一段时间来观察已接种者。如果接种者对低剂量的注射证明是可以接受的,那么第三组受试者每次将接受250微克的疫苗注射。
纽约时报报道称,受试者将被追踪一年左右,但Moderna首席执行官Stéphane Bancel在接受采访时表示,注射后数周即可获得安全性数据,并表示,如果疫苗看上去安全,那么即使在第一阶段试验完成之前,Moderna也会要求美国食品药品监督管理局(FDA)批准进入下一阶段的测试。
第二阶段的临床试验旨在衡量功效并验证安全性,也将招募更多的受试者。
二期临床试验通常会招募数百人,并对受试者进行几个月到两年的监控。科学新闻网站Live Science表示,二期临床试验中研究人员将选择相匹配的受试者,这些受试者应当与疫苗开发针对的人群相匹配,尽管任何人都可能感染新冠病毒,但高龄者和慢性病患者有更高概率出现严重症状,因此在二期临床试验中应考虑这一点。
而第三期临床试验通常需要在1至4年内观察300至3000名受试者,且随着人数的增加,研究人员可以注意到该药物的异常副作用,并证明给定的药物可提供预期的益处。
NIAID主任Anthony Fauci博士3月12日曾表示,任何开发中的新冠疫苗,假设初始测试顺利进行,则可能还需要12到18个月的时间才能将其投入公众使用。
此外,即便经FDA批准后,疫苗和药物通常都会进行四期临床试验,即新药上市后应用研究阶段,考察在广泛使用条件下的药物的疗效和不良反应,评价在普通或者特殊人群中使用的利益与风险关系以及改进给药剂量等。
02.为何直接进入人体试验阶段?
值得注意的是,Moderna公司的疫苗没有经过动物试验,而这通常是进入人体试验的严格前提。这一环节的省去也使Moderna的疫苗进度从一众产品中脱颖而出。
动物模型是什么呢?“形象的说,就是在实验室里研制的新冠‘病人’。疫苗和药物都要经过这种特殊的‘病人’的检验,才能用到真正的病人身上。”中国医学科学院实验动物研究所研究员秦川在今天下午的国务院联防联控机制新闻发布会上表示。
“要生产出合格疫苗样品,在动物实验中证明安全有效性后,才能进入临床试验。”中国工程院院士王军志在发布会上表示。
对于缺乏动物模型试验数据,Moderna公司有不同的观点。Moderna首席医学官Tal Zaks在接受媒体采访时表示:“我不认为在动物模型中证明这一点,是将其用于临床试验的关键途径,美国国立卫生研究院的科学家正在并行开展非临床研究。”
复旦大学病原微生物研究所所长姜世勃昨天则在Nature在线发表评论称,不花费时间完全了解安全风险就去测试新冠疫苗和药物,将会给现在的新冠大流行甚至未来带来更多不必要的障碍。
姜世勃认为,在允许试验疫苗用于人体之前,监管者应当评估不同种类病毒株和不止一种动物模型中的安全性,同时需要强有力的临床前证据,即使这意味着要花费更多时间。姜世勃以他对SARS病毒的研究表明,一些令人担忧的免疫反应出现在猴子和雪貂身上,而老鼠则不会出现,同时不同的病毒蛋白片段所引发的反应也不尽相同,“这些都表明人体试验前的动物试验很有必要”。
“NIAID认为,推迟疫苗研发的风险远高于健康志愿者安全的风险,但我担心,如果降低标准,疫苗研发会过于草率。”姜世勃在评论中写道。
王军志表示,目前,中国疫苗领域的科学家正按照相关法规和技术要求,一方面全力以赴,争分夺秒,一方面坚持按科学规律办事,保证疫苗的安全性和有效性的前提下,加快疫苗研究应用。
03.中国的进度到哪了?
由于Moderna的核酸疫苗减去了动物试验的环节,目前其研发进度已经处于领先阶段。
昨天(3月16日),陈薇院士团队研制的重组新冠疫苗获批启动展开临床试验。据信,这一产品就是康希诺今日表示启动志愿者预招募的产品。但该疫苗目前还未有动物模型测试数据公开。
“我国已有研发进展比较快的单位,向国家药监局滚动递交临床试验申请材料、并且已经开展临床试验方案论证、招募志愿者等相关工作。待国家药监局按照有关法律法规审批后,开始临床试验。”在今天的发布会上,王军志通报了国内最新的进展。如不出意外,他所说的这个疫苗便是康希诺与军事医学研究院联合开发的疫苗。
康希诺生物于2019年3月28日登陆港股,主营研发及生产人用疫苗,在肺炎、结核病、埃博拉病毒病等多类大型传染病领域拥有15种在研疫苗产品。
值得注意的是,康希诺自研产品埃博拉病毒疫苗于2017年10月在中国获批上市,是全球两个获批的埃博拉疫苗之一。
“截至目前为止,五大技术方向疫苗都总体进展顺利,第一批确定的9项任务都已完成临床前研究(也就是动物的有效性、安全性研究)的大部分工作,大部分研发团队4月份都能完成临床前研究,并逐步启动临床试验。”王军志说道。
据和君医药医疗事业部的不完全数据统计,目前全球新冠疫苗研发项目66个,至少有96家公司和学术团体,已经宣布了66个COVID-19疫苗开发计划。其中,中国有57家,占比约60%,包括36家制药企业、生物技术公司,以及21家学术机构、团队。
3月15日,复星医药发布公告称,已与BioNTech签订协议,将在中国独家开发和商业化BioNTech的mRNA技术平台研发的新冠疫苗产品。第二天,纳斯达克上市公司BioNTech随即宣布了最新研发进展,计划在获得监管批准后,将于2020年4月下旬启动全球临床试验,同时,BioNTech表示正与辉瑞积极洽谈全球除中国外的新冠疫苗研发合作。
在诸多疫苗研发技术中,受关注度最高的当属mRNA疫苗,包括康希诺、Moderna、BioNTech、斯微生物等研发的新冠疫苗都属此类,但康希诺此次申请的为腺病毒载体疫苗。
和君医药医疗事业部介绍道,mRNA疫苗是一种新型疫苗,其优势在于制备步骤简单、开发与生产周期短,对流行病疫情可以较快反应。相对于常规药物的研发与检测,mRNA的合成不仅简单快速,且价格低廉。更重要的是,与稳定的DNA不同,行使过功能的mRNA随后便会降解,不会对人体产生其他的毒害或副作用。
但目前,全球范围内还未有任何一种mRNA疫苗获批。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..