应对公共卫生紧急事件的医药对策(MCM)产品开发、批准和使用面临哪些关键科学和监管挑战?FDA通过医药对策产品计划(Medical Countermeasures Initiative, MCMi),应对相关的关键挑战。
2001年“911”事件以后,对医药对策(MCM)产品进行了大量投入,但要做好准备,应对化生放核剂攻击或应对新出现的传染病威胁,仍有大量工作要做。2010年,在对美国公共卫生紧急医疗对策领域开展调研之后,FDA很快启动了医疗对策计划(MCMi),以促进医疗对策产品的开发和供应,对抗化生放核剂和新出现疾病的威胁。作为监管机构,FDA在这项关系到国计民生的事业中,发挥着无可替代的关键枢纽作用。FDA采用三支柱方法,应对与医疗对策产品监管、审评流程相关的关键挑战。这些关键挑战,包括用于MCM产品开发与评估的监管科学方面的缺位;以及行之有效的有效公共卫生对策的相关法律、监管和政策框架等。填补MCM产品研发、制造领域的空白,是一项艰巨的系统过程,需要所有利益攸关方的协作,包括联邦合作伙伴、MCM产品开发机构、相关研究机构,以及各州与地方响应机构。取得成功的关键,是深入了解与制定医疗对策相关的长期性、风险和高成本,有效实施这些对策的体系,以及包括国家领导在内的所有利益攸关方的通力支持。
前言
2001年发生的“9.11事件”,以及随后在美国境内邮寄的装有炭疽的邮件,永远改变了美国公众对公共卫生和国家安全的看法。自2001年以来投入了大量财力和人力,力图建立医药对策或相应的体系,迅速有效地应对蓄意的化生放核剂袭击或自然发生的传染病疫情。 MCM产品指应对突发公共卫生事件所需的药品、疫苗和医疗器械(包括诊断测试、器械和用具),包括预防和应对炭疽、天花、放射性/核制剂、流感大流行,以及其它新出现疾病的产品。

▲医药对策产品(MCMs)(数据来源:参考资料[1],药品康德内容团队制图)
为了填补MCM产品的空白,产品开发者与美国政府面临着特殊的挑战,大多数的挑战,可以归于下述两大类:(1)很多医药公司热心开发MCM产品,但经验相对欠缺;(2)从伦理与实际角度看,由于不少MCM产品无法开展人体试验,意味着很多有效性数据(尽管并非全部数据),必须来自于动物实验。因此,开发者与政府面临着科学与监管方面的问题,以及(监管的)不确定性问题。
联邦政府在促进MCM产品的开发和采购,以及解决相关的监管和科学挑战方面,发挥着至关重要的作用。由卫生与公众服务部(HHS)防备和响应助理部长办公室(ASPR)[2] 领导公共卫生紧急医疗对策事务机构(Public Health Emergency Medical Countermeasures Enterprise,PHEMCE)。[3,4,5]
PHEMCE从医药对策产品(MCM产品)的角度,协调联邦政府的工作,以加强防范化生放核与新出现传染病(emerging infectious diseases,EID)的努力。PHEMCE包括卫生与公众服务部属下的3个机构合作伙伴:疾病控制和预防中心(CDC)、FDA和国家卫生研究院(NIH);以及一些机构间合作伙伴:国防部(DoD),退伍军人事务部(VA)、国土安全部 (DHS)和美国农业部 (USDA)。通过机构内与机构间协作,PHEMCE致力于支持和鼓励开发、采购和储备MCM产品。作为药品监管机构,FDA在评估医药产品的安全性、有效性方面,发挥着无可替代的关键枢纽作用。

▲公共卫生紧急医疗对策事务机构(PHEMCE)标识 (图片来源:PHEMCE官网)
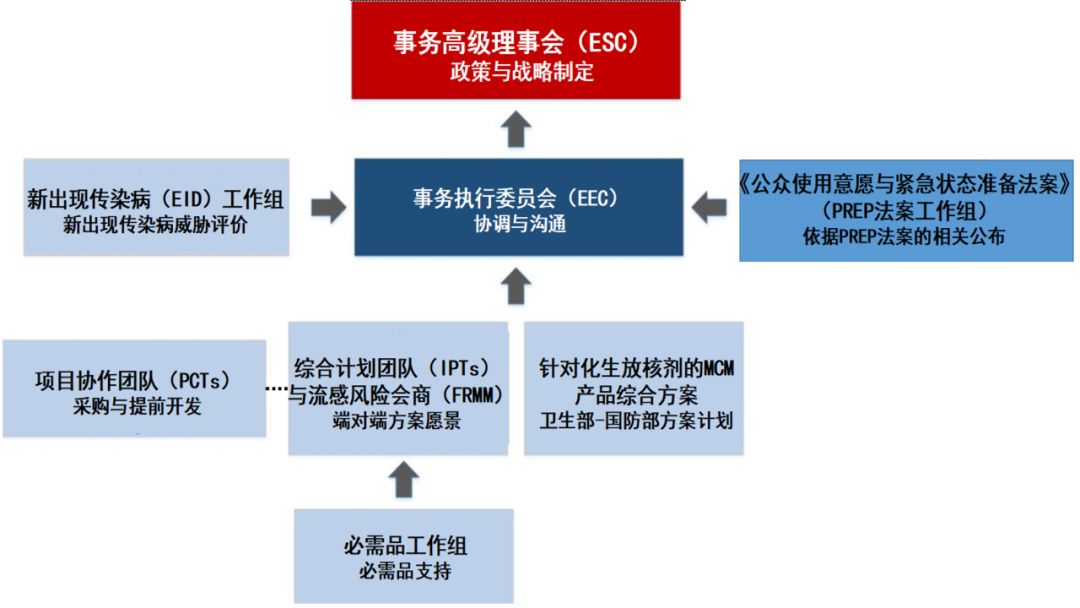
▲公共卫生紧急医疗对策事务机构(PHEMCE)组织架构(数据来源:参考资料[2])
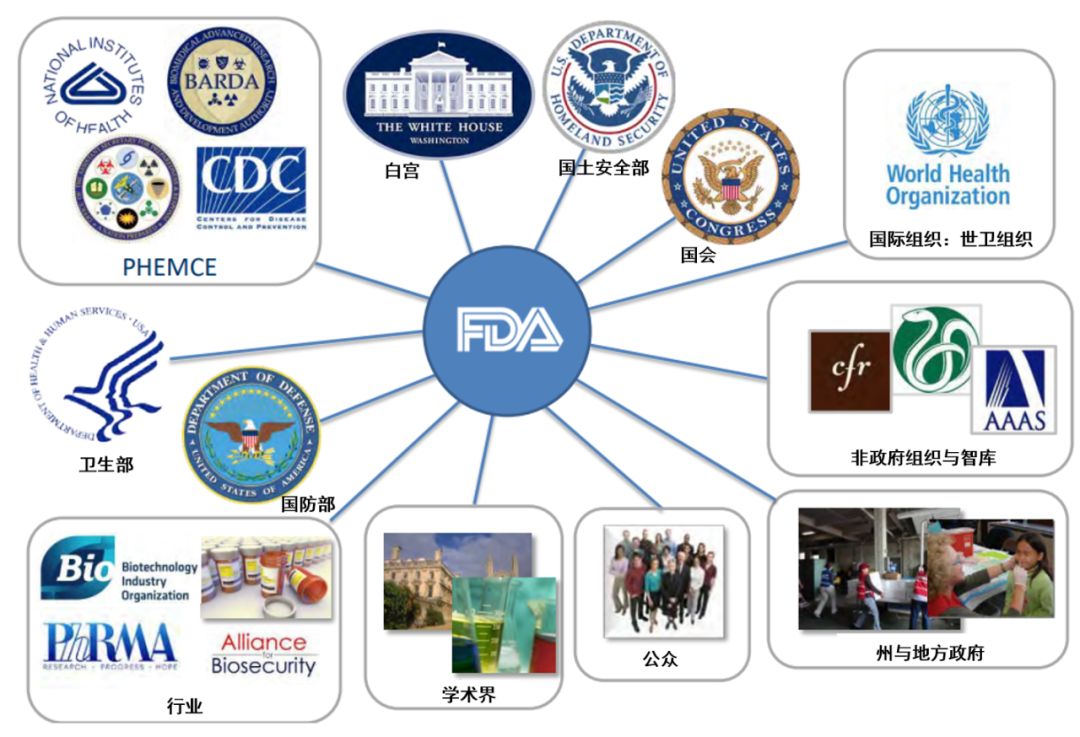
▲PHEMCE利益攸关方(图片来源:参考资料[6],注:BRADA:The Biomedical Advanced Research and Development Authority,BARDA,生物医学高级研究与开发机构)
2010年,时任卫生与公众服务部部长Kathleen Sebelius医生发布了对MCM产品事业的详细评估结果,阐明了MCM的新战略愿景(HHS,2010年)。依据评估结果,FDA在2010年8月建立FDA医药对策产品计划(MCMi),以促进高优先级MCM产品的开发和供应,加强MCM产品事务。由FDA局长办公厅所属的反恐和新出现威胁办公室(the Office of Counterterrorism and Emerging Threats,OCET)负责协调执行医药对策产品计划(MCMi)。医药对策产品计划(MCMi)的顺利实施,在FDA内部,涉及生物制品审评与研究中心(CBER)、器械与放射卫生中心(CDRH)、药品审评与研究中心(CDRH)之间的密切协作;同时涉及与FDA外部的联邦合作伙伴与相关利益攸关方的密切协作。
FDA采取了三支柱方法完成医药对策产品计划(MCMi)使命,即(1):加强MCM监管审评流程;(2)推进MCM产品研发与评估的监管科学;(3)使针对有效公共卫生对策的法律、监管和政策框架现代化。[7,8,9]

▲FDA采取了三支柱方法完成医药对策产品计划(MCMi)使命(数据来源:参考资料[9],药品康德内容团队制图)
MCM产品开发和保障供应所面临的主要科学与监管挑战
与开发其它的医药产品的复杂过程相比,MCM产品的开发和保障供应所面临的挑战更为复杂、艰巨。通常,MCM产品的开发和审批,必须遵循FDA严格的审评流程。然而,在许多情况下,MCM产品开发往往面临实际困难,例如,人体有效性数据有限,科学和监管方面存在的障碍,所面临的挑战可能比经典的药物开发更大。此外,医药产品开发,需要投入大量资源,根据最新估算,开发一个成功上市的新药的费用从8亿美元到13亿美元以上。[10] 尽管依据2004年《生物恐怖防疫计划法案》(the Project BioShield Act),通过政府收购某些MCM产品,包括尚未获得许可或批准的MCM产品;但是,对MCM产品的投资回报,可能无法与其它畅销的医药产品可能获得的回报相比。面临的这些挑战,以及很多应对化生放核剂引发的紧急状态的MCM产品,可能会因为缺乏商业吸引力,使得在符合复杂的监管要求方面拥有丰富经验,并有成功的追溯经验和追溯记录的大多数医药公司,不愿意承担MCM产品的开发。这样的情况,会使得一些产品在进入药品监管机构的针对性审评、审批流程之后,前功尽弃。[11]
由于面临这些科学挑战,FDA在出台《MCM产品计划》(MCMi)后的第一年,工作重点是规模较小的生物技术公司(通常是初创公司),这些公司往往在技术上很强,但缺乏或者很少有全程走过FDA审评、审批流程的经验。与规模更大、更具有申请注册经验的制药公司相比,在相关产品开发过程的早期和整个过程中,FDA为相关公司提供更多的监管和科学指导,这一点至关重要。对于FDA,对产品开发者采取这种亲力亲为的方法,并非一桩新鲜事。然而,这种亲力亲为的方法,需要投入大量的资源。但是,FDA对于MCM产品的专业知识,以及确保在为多个MCM产品申办方提供援助时保持公平性,存在局限。FDA在审评MCM产品申请材料时,面临前所未有的科学挑战和不确定性,加剧了这种局限。
加强MCM产品监管审评流程
自2010年推出MCMi计划之后,FDA增加了用于与MCM产品开发有关的正式会议与非正式会议的人员安排与资助,包括增加临床前会议(pre-IND meeting);在FDA内部,扩展就MCM相关议题的科学和技术协商。对于相关各方所关切的FDA的各个审评中心在解读和执行各项法规和政策时,可能出现的一致性不充分的问题,FDA也着力加以解决。例如解读2002年FDA颁布的《新药和生物药品;当人体功效研究不符合伦理或不可行时,需要证据来证明新药的有效性》(即业界所称的“动物有效性规则”或“动物规则”,Animal Efficacy Rule,Animal Rule),[12,13] 证明新药有效性所需的证据(动物实验规则)及其配套的指南。在其它情况下,很多问题可能经常被误认为只是监管问题,但本质上,这些问题是由于在关键科学知识领域存在空白所致,因此阻碍了FDA的监管指导和决策能力。

▲FDA采取了三支柱方法完成医药对策产品计划(MCMi)使命(图片来源:参考资料[15])
为了解决这些问题和不确定性,FDA成立了跨学科、跨职能部门的公共卫生和安全行动团队(Public Health and Security Action Teams,Action Teams行动团队。作者注:请注意,这里的团队用的是复数),成员由来自于FDA各个审评中心的专家组成,包括来自于各个中心的具体审评部门的成员。行动小组加强了FDA内部的合作与信息交流,在可能的情况下促进了更多的统一性和一致性。行动小组对阻碍MCM产品开发障碍和差距的类型做出认定和分类,为协调FDA与联邦合作伙伴利益攸关方的沟通交流提供了有效手段。[15,16]
行动团队通过分析确定了一些障碍,这些障碍主要是科学知识方面的空白,以及法律、法规或政策方面的限制。科学方面的空白,包括对新发疾病所造成威胁的疾病过程了解有限,以及对正在开发的特定化生放核剂适应症的MCM产品的安全性、有效性方面。找出具体的科学空白后,FDA将与联邦合作伙伴紧密合作,确定解决这些空白的最佳方法,从而制定针对MCM产品的监管科学研究计划。[17] 法律、法规和政策方面的局限,包括对现有法律、法规或政策的解读和贯彻落实不一致,缺乏开发具有创新性的MCM产品与技术的适用框架。在确定具体局限之后,FDA通过机构内协作,并与卫生部、国会和其它相关合作伙伴协作,解决这些局限。
依据公共卫生紧急医疗对策事务机构(PHEMCE)确定的优先研发领域,FDA组建了多个行动团队。最初的工作重点涵盖体外诊断、急性放射综合征、创伤与作战人员、先进制造和开发,以及儿科和产妇面临的相关问题。FDA还制定和推出动物模型资质确认计划,[18] 在使用环境下对产品没有偏倚的评估和资质鉴定。同时,FDA还制定了响应指南。最新的指南,是2019年12月公布的《行业与FDA员工指南:用作药品研发工具的资质确认流程》(指南草案)。[19]
推进MCM产品监管科学
药品审评是药品监管的核心所在。FDA对药品监管的上百年历史中,在履行其使命的过程中,最为显著的特征,是依靠科学作为决策的主要基础,并因此成为世界上最受尊重的药品监管机构之一。[20]
2010年,FDA启动“推进监管科学计划”,FDA产品中心制定了监管科学议程和优先事项,以支持更积极地参与科学研究,促进所有FDA监管产品的开发(FDA,2010a)。[21,22]
FDA将监管科学定义为开发新工具、标准和方法,用于评价FDA监管的所有产品的安全性,功效,质量和性能的科学。[23]
MCM产品计划(MCMi)监管科学计划的目标,是开发用于评价MCM产品的安全性、有效性、质量和功效,帮助将尖端科学技术转化为创新性科技、安全有效的MCM产品的工具。[24]
FDA MCM产品计划(MCMi)监管科学的7个重点领域包括:[25]
(1)动物模型
(2)生物标志物与临床免疫学
(3)诊断与器械
(4)私营企业制造与相关检定方法开发
(5)辐射损伤保护与响应
(6)卫生与科学计算
(7)风险沟通
针对MCM产品的监管科学,加强了FDA的机构内MCM监管科学研究项目。MCM产品计划(MCMi)以多种方式吸引多个利益攸关方的广泛参与。在MCM产品计划(MCMi)推出之初,FDA与NIH共同举办了研讨会,广泛探讨MCM产品开发的科学背景,确定了就监管科学议题开展合作的机会。[26]
紧接着,MCM产品计划(MCMi)成立了指导委员会,以同行评议的方式评议各个中心具体的监管科学研究项目标书,以寻求获得FDA MCMi计划资助。指导委员会成员,由FDA首席科学家,来自FDA的3个医药产品中心的科学负责人,以及来自于公共卫生紧急医疗对策事务机构(PHEMCE)合作伙伴的代表,包括国防部、疾控中心、NIH与卫生部防备和响应助理部长办公室(ASPR)的代表组成。评估研究项目标书的重要性,与公共卫生紧急医疗对策事务机构(PHEMCE)优先事项的一致性,科学可行性和协作环境。相关的协作环境评估,包括考虑当前的机构内部协作、当前与公共卫生紧急医疗对策事务机构(PHEMCE)合作伙伴的合作,以及评估潜在协作的机会,从而最大程度地发挥协同效应。在上述工作的基础上,FDA发布了一项信息请求,向利益攸关方征求进一步的建议、意见,以加强和完善现行的MCM产品监管科学研究计划,制定监管科学方案。FDA的监管科学计划,旨在全面解决开发管线中有碍MCM产品开发进度的科学挑战,并生成推动产品获得批准和可用性必需的数据。
MCM产品计划(MCMi)监管科学计划,为FDA的所有MCM监管科学产品组合提供监督和指导,并作为的来自于征集利益攸关方建议、意见,用于制定研究议程渠道。MCMi监管科学计划通过支持内部研究与资助外部研究,开发相关工具。MCMi监管科学计划目前支持的内部研究优先领域包括:[27]
(1)开发用于评估安全性和有效性的动物模型和工具;
(2)安全性和有效性生物标志物鉴定和资质确定;
(3)使用蛋白质工程来稳定疫苗蛋白质;
(4)开发评价MCM产品质量与相关产品放行分析的方法验证的下一代体外诊断平台;
(5)急救医疗设备性能评价;
(6)增强应急准备和响应能力,包括风险沟通、跟踪和评估在公共卫生紧急状态下使用的医疗对策的安全性和临床获益。
MCM产品开发面临的主要科学挑战之一,是在很多情况下,由于疾病自然稀发,或零星发生,或者由于伦理问题(例如相关发病率/死亡率),不具备开展人体疗效研究可行性。在这样的情况下,MCM产品申办方必须通过非传统的监管途径寻求批准,例如借助于前述的“动物规则”。尽管“动物规则”提供了一条审批的替代途径,但由于以一种全新的方式运用实验动物研究数据,“动物规则”导致了复杂的科学与监管难题。MCM产品开发和评价借助于“动物规则”,创造了对相关动物模型的很大需求,但在很多情况下,并没有现成的相关动物模型可用。一旦开发出能够充分反映特定疾病的人体状况的实验动物模型,对这些实验动物模型,可能需要具体针对特定产品做出调整,在某些情况下,由于存在物种特异性差异(例如,生理学、免疫学、药代动力学/药效动力学),或产品专属性差异(例如,不同物种中的受体,不一定会存在免疫调节剂靶向作用)。需要有针对性的监管科学研究,来弥合物种间差距,确定可接受的保护关联;或开发新的方法,如体外或虚拟建模(in silico modelling),借助这些有效手段,推进相关的MCM产品开发。
2015年10月,FDA药品审评与研究中心(CDER)、生物制品审评与研究中心(CBER)公布了《行业指南:根据动物规则的药品研发》最终版(Guidance for Industry: Product Development under the Animal Rule)。[28]
实际上,依赖动物数据,使得MCM产品开发的科学复杂性呈指数倍增加,并因此导致监管不确定性增加。
根据FDA官网公布的资料,截至2018年7月13日,根据“动物规则”批准的药品共计14个,参见表1。[29]

▲表1. FDA CDER与CBER依据动物规则批准的药品与生物制品名录[29](药明康德内容团队制图,注:*TPOXX同时获得优先审评凭券)
药品审评和研究中心(CDER)的职能主要体现在新药(化学药、生物制品中的单克隆抗体和治疗性蛋白质)、通用名药品(包括生物类似药)和非处方药的上市前审评和上市后监管方面。包括含氟牙膏、止汗剂、去头屑洗发水和防晒霜等被认为是“药用”品,也属于CDER的监管范围。[30] 生物制品审评与研究中心(CBER)负责确保生物制品和相关产品(例如疫苗、活体生物治疗物/益生菌、血液制品、细胞、组织和基因疗法)的安全性、纯度、效价和有效性。并非所有的生物制品都由生物制品审评与研究中心监管,单克隆抗体和治疗性蛋白质由药品审评与评价中心监管。[31] 医疗器械与放射卫生中心(Center for Devices and Radiological Health, CDRH)负责医疗器械的上市前审评和医疗器械生产、性能与安全性监督。医疗器械与放射卫生中心还负责发射某些类型的电磁辐射的非医疗器械辐射安全性监督,例如蜂窝式移动电话、微波炉、机场 行李检测设备、电视接收器、微波炉、紫外线保健房和激光产品。[32]
上表中的14个药品的获批适应症,都是依据“动物规则”获得批准。其中获批的一些相关适应症,得益于之前在其它国家或地区获批的其它适应症或相关资料。因此,即便针对这些药品,已经建立了足够的安全性和有效性数据,佐证对于实验动物的相关疗效;或者有支持相关适应症的相关数据,提交给FDA根据“动物规则”审批,并不意味着将实验动物数据替代人体试验数据,会是一条更容易、便捷的途径。[33]
法律、法规、政策框架现代化
《联邦食品、药品与化妆品法案》(《FD&C法案》),为FDA提供了各种法律和监管架构与机制,以促进MCM产品开发和注册审评。依据《FD&C法案》的相关规定,FDA可通过要药品紧急授权(emergency use authorization,EUA)机制,允许在某些情况下,授权紧急使用某些未经批准的医药产品,或是已获批医药产品的未经批准的用途。[34]
MCM产品的开发和批准,必须严格遵循法定的医药产品注册审评审批流程:对于新药,应通过针对新药申请(NDA)的§505(b)(1) (《FD&C法案》),针对改良新药的§505(b)(2) (《FD&C法案》),针对简化新药(仿制药)申请的§505(j) (《FD&C法案》);对于生物制品许可申请(BLA),应通过针对生物制品许可申请(BLA)的§351(a)(《公共卫生服务法案》,PHS法案),针对生物类似药(biosimilar)的§351(k)(2)(A) (《PHS法案》),以及针对可互换生物类似药(interchangeable biosimilar)的§351(k)(2)(B)(《PHS法案》);对于器械,则通过上市前批准或通过§510(k)(《FD&C法案》)。[35,36]
涉及的具体措施,包括加速批准、优先审评、特殊临床试验方案评价(special protocol assessments,SPA)、“动物规则”等。特别临床试验方案评价,指针对未完成的3期临床试验的设计、临床终点和统计分析的具体情况,FDA提前声明,可以进入审批流程。[37]
2001年炭疽邮件事件后,颁布的《公众使用意愿与紧急状态准备法案》(Public Readiness and Emergency Preparedness Act,《PREP法案》);[38]
建立了一些关于MCM开发、批准、提供和使用的特殊法律和监管机制。在实际紧急情况期间或预期发生实际紧急情况时,FDA可以通过扩展使用机制,使用相关医药产品(FD&C法案,第561节;21 U.S.C. 360bbb)。[39,40]
或通过紧急使用授权(EUA)(FD&C 法案,564,21 U.S.C. 360bbb-3),[32,41], 以及没有EUA的情况下,紧急使用MCM产品。[42] 通过综合运用上述措施,促进相关方面将所需的MCM产品投入使用。(有关药品紧急使用授权的详细介绍,请参阅药明康德内容团队文章:《美国FDA如何开展医药产品紧急使用授权?》;《FDA如何开展没有医药产品紧急使用授权情况下的医药产品紧急使用》;有关药品扩展使用的详细介绍,请参阅《权威机构报告:FDA与医药商支持让临床亟需患者用上试验用药》。)
2002年6月颁布的《公共卫生安全和生物恐怖主义防范和应对法案》(Public Health Security and Bioterrorism Preparedness and Response Act of 2002),首次以立法的形式明确“动物规则”。[43]
2004年《生物恐怖防疫计划法案》(the Project BioShield Act),以立法的形式明确医药产品紧急使用授权。[44,45]
2006年《大流行与全风险防范法案》(the Pandemic and All-Hazards Preparedness Act, 《PAHP法案》),明确规定在MCM产品短缺时,提供技术援助小组。[46]
2013年《大流行与全风险防范再授权法案》(Pandemic and All-Hazards Preparedness Reauthorization Act of 2013,《PAHPRA法案》),再次予以明确。[47]
为激励医药行业开发MCM产品,2016年12月颁布的《21世纪治愈法案》(the 21st Century Cures Act),明确扩展优先审评凭劵计划(priority review voucher),覆盖应对化生放核剂所致威胁的MCM产品。[48], [49], [50], [51](有关药品申请优先审评的详细介绍,请参阅药明康德内容团队文章《一文读懂“优先审评凭劵”的前世今生》。)
2017年12月12日颁布的《第115-92号公法》(Public Law 115-92/H.R.4374),对《FD&C法案》第564节做出修订,允许针对除化生放核剂之外的其它物质对军人造成严重生命威胁或特定危险或与之相关情况下,紧急使用相关医药产品。该法案授权国防部(DoD)要求FDA提供协助,加快开发速度以及FDA对相关产品的审评,以诊断、治疗或预防军人面临的严重或威胁生命的疾病或病症。[52]
2019年6月12日颁布的《大流行与全风险防范与推进创新法案》(Pandemic and All-Hazards Preparedness and Advancing Innovation Act,《PAHPAIA法案》),重新授权和加强卫生与公众服务部的相关职能,以应对新出现传染病和化生放核剂威胁所致的灾难与威胁。该法案明确鼓励开发新的MCM产品,以及储备重要的医药产品和用品。《PAHPAIA法案》授权了一系列区域性医药应急准备与响应系统,同时授权了医院和其它医疗设施的相关计划。[53]
《PAHPAIA法案》以法律条文的形式,进一步增强了FDA促进MCM产品开发与保障供给的使命。包括:(1)保持充足、安全的国家血液供应;(2)保证MCM监管计划的信息随时可用;(c)支持通过使用MCM产品主文件来开发和制造MCM产品;(4)对国家卫生安全构成威胁的网络安全威胁的公共卫生策略与防范、响应;(5)阐明与紧急使用说明(emergency use instruction)、贮备用于紧急使用和药物开发工具相关的现行授权。[53]
《PAHPAIA法案》还正式确定FDA在公共卫生紧急医疗对策事务机构(PHEMCE)中的成员、作用与职责,以及作为多国灾害咨询委员会的职责,建立和明确FDA与其它跨部门合作伙伴之间的关键跨部门协作。[53]
依据相关法律规定,“动物规则”(化学药适用,美国法典汇编第21编314节:600-650,21 CFR 314.600-650;[54] 生物制品适用,21 CFR 601.90-95;[55])的规定,自2002年7月1日起,允许在人体疗效研究不合乎伦理,在临床试验场所开展药物与生物制品临床试验不可行的情况下,批准相关的药品申请与生物产品许可申请。动物规则用于为减少或防范因接触致命或永久禁用的有毒化生放核剂而造成的严重或危及生命的物质和生物质。依据“动物规则”,根据对人体疾病或与所关注紧急状况有关的实验动物模型进行充分和严格合规的研究,确定疗效,并根据针对药品和生物产品的既有要求评价安全性。根据“动物规则”批准的MCM产品,对保护公众健康和国家安全至关重要。
作为MCM产品计划(MCMi)的重要组成部分,通过法律、监管和政策框架现代化,实现有效的公共卫生对策,为化解相关的法律和监管问题,提供了必不可少的支撑条件。法律、监管和政策框架现代化的目标,是通过确保美国法律、法规和政策支持监管科学发展,将监管科学成果付诸于运用,未雨绸缪,支持MCM产品开发与保障供给,积极、充分地支持美国对化生放核剂与新出现传染病威胁的准备与响应。此外,法律、监管和政策框架现代化相关部门的工作人员,一直在评估现行法律、监管和政策环境对MCM产品开发、发放、供应和使用方面,具有哪些优势和劣势。在需要做出改变,以更好地保护公众健康的地方,FDA一直与联邦政府合作伙伴和相关的利益攸关方合作,确定和提出新的方法,改进FDA法律、法规和政策框架并使之现代化,确保有效的公共卫生应急响应。在2013年《大流行与全风险防范再授权法案》(Pandemic and All-Hazards Preparedness Reauthorization Act of 2013,《PAHPRA法案》)起草过程中,根据贯彻落实2006年《大流行与全风险防范法案》(《PAHP法案》)中的经验与教训,FDA提出新增相关内容的建议。这些建议包括,(1)在化生放核剂所致的紧急事件发生前,提高医药产品紧急使用授权(EUA)的清晰度和灵活性,以加强快速部署;(2)更好地促进MCM产品的事前规划与前置;(3)阐明FDA对扩展在储备的MCM产品效期的授权;(4)澄清为准备或在紧急情况下所采取的某些行动不会违反FDA法律。为根据利益攸关方需要,支持对碳蛆热的防范与响应,FDA与联邦政府利益攸关方协作,在2011年7月颁布了大批量发放相关MCM产品的紧急使用授权,并在2011年10月修订了邮寄模式紧急使用授权。[56]
2011年10月,FDA修订邮政模式紧急使用授权(EUA)。[57] 同时,FDA与联邦政府合作伙伴合作,多次召开相关会议,参会人员来自于联邦政府合作伙伴、医药行业、学术界、非政府组织、公众等。FDA还推出面向行业的MCM产品计划教育项目,培训相关人员。
除了国会立法之外,作为联邦机构(agency),FDA获得授权,能够发布相关的法规、指南。[58] 通过发布行业指南,为行业与FDA员工提供指导。在草拟行业指南的过程中,由跨中心、多学科的团队,认真审议指南草案公示期间征集到的来自于利益攸关方的建议、意见。[59] 行业指南的作用,在于使得行业不会分心,将精力集中在最有影响力的方面。[60]此外,FDA还具有执法自由裁量权。[61]
FDA在抗击新冠病毒中的相关行动
今年1月27日,在公布的新冠肺炎死亡例数超过1000人之际,FDA宣布相关采取行动,推动制定针对新冠病毒对公共卫生威胁的对策。FDA在公告中指出,FDA正与其它联邦机构、全球监管机构、产品开发商和国际合作伙伴合作,“加快开发和提供诊断所需的医疗产品,治疗、减轻和预防疫情。”[62,63]
FDA正在采取以下步骤:(1)共享相关流程的更新,帮助开发人员了解包括紧急使用授权(EUA)在内的相关监管途径,这些途径可能有助于快速推进对新冠病毒的医药对策。(2)及时向公众发布关键信息,以帮助支持医药产品的及时开发。[64]
FDA特别强调了临床试验申请前(pre-IND)咨询,鼓励申办方开发针对冠状病毒的治疗药物。
FDA鼓励对关注EUA途径的诊断测试申办方开展相关测试,并公开了联系方式,以获得相关模板[65]和更多信息。
FDA指出,能够快速、准确诊断感染新型冠状病毒的患者,是帮助患者确定需要医治、减轻病毒向他人传播的必不可少的步骤。目前在美国,尚无商购的可检测冠状病毒的产品。FDA正在“积极致力于促进这类诊断程序的开发和保障供给”,并“正在与公共卫生合作伙伴合作,以推进和共享促进诊断开发所需的参考材料。”
FDA局长Stephen Hahn医生指出,“FDA肩负着保护和促进公共卫生的重要使命,正在积极利用FDA广泛的专业知识,采用FDA的所有公共卫生手段,以促进临床试验用医药产品的开发和供应,帮助解决当前的紧急公共卫生状况。”日前,Hahn局长在美国临床实验室协会(American Clinical Laboratory Association,ACLA)的演讲中指出,“错误的检测结果(尤其是在紧急情况下),会给公众健康带来广泛的影响,而不仅仅是对被测患者的影响。EUA标准没有更改,但在目前,按照相关指南所述,开发和验证实验室开发检测(laboratory-developed test,LDT)的一些实验室,可以立即行动起来。”对于诊断,FDA通常与开发者共享模板提交内容,并与开发者滚动合作,通常在收到完整数据包的24小时之内完成审评。日前,FDA宣布了针对相关实验室的新政策,立即使用这些相关实验室开发和验证的检测,以实现更快的检测能力。对于药品监管机构所发挥的作用,Hahn局长在讲话中,提请与会者“考虑一个稍微不同的例子。如果大家要盖房子,就要有法规来确保建材的质量,而且需要确保建房的方式不会危及房子和未来的入住者安全。”“作为一直处于这种监管结构两端者,敦促大家仔细考虑适当监督的重要性,以帮助确保使用分析和临床上有效的检测。”“需要确保大家的检测准确、可靠并具有临床意义。”[66]
表2、表3为FDA在新冠病毒紧急公共卫生状态中颁布的紧急使用授权。
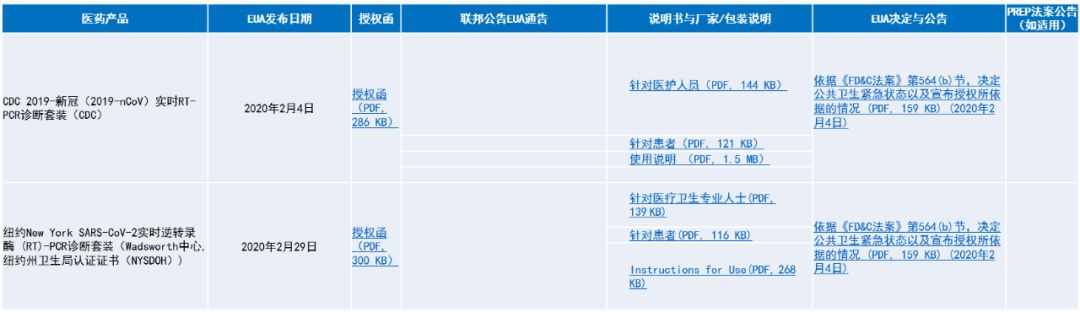
▲表2. 新冠病毒EUA(诊断)[65]

▲表3. 新冠病毒EUA(个人防护装备)[65](注:NIOSH, National Institute for Occupational Safety and Health,国家职业安全与卫生研究院)
结语
FDA在确保成功开发MCM产品方面,发挥着关键的枢纽作用。凭借灵活、高效的体系,在发生相关紧急事件时,能够有效应对。MCM产品计划(MCMi),有助于成功解决监管审评流程相关的主要挑战,弥补在MCM产品监管科学方面的差距。通过法律、法规和政策框架现代化,去除有碍MCM产品开发的障碍。填补MCM产品的空白,是一项长期、复杂、艰巨的工作,需要联邦政府利益攸关方、学术界、行业和医疗卫生专业人士之间的有效协作。真正做到未雨绸缪、群策群力、有备无患,需要社会各界真正了解,MCM产品开发时间长、风险大、成本高,需要大量和持续投入,相关各方的定力和大力协作,不可或缺。
附件:表1. FDA CDER与CBER依据动物规则批准的药品与生物制品名录(EXCEL表)
表2、表3. 新冠病毒EUA(诊断、个人防护装备)(带链接的EXCEL表)
(编者注:感兴趣的读者可向药明康德微信号后台留言索取附件)
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..