在日前发表的《美国FDA如何开展医药产品紧急使用授权》 一文中,我们详细介绍了在紧急状态下,FDA如何开展医药产品紧急使用授权(emergency use authorization,EUA)。紧急使用授权(Emergency Use Authorization,EUA)可能会是资源密集型过程,需要监管机构投入大量的人力、时间。 在紧急状态或面临潜在威胁情况下,还有一种更为顺畅的机制,严格地依法依规,促进涉及某些已获得FDA批准的医疗对策(Medical Countermeasures, MCM)产品的准备和响应活动,而无需FDA签发紧急使用授权(EUA)。
1. 相关法律
本文所涉及的相关法案,包括《联邦食品、药品与化妆品法案》(the Federal Food, Drug, and Cosmetic Act,《FD&C法案》);《公共卫生服务法案》(Public Health Service Act);2004年《生物恐怖防疫计划法案》(the Project BioShield Act);《公众使用意愿与紧急状态准备法案》(Public Readiness and Emergency Preparedness Act,《PREP法案》);2013年《大流行与全风险防范再授权法案》(Pandemic and All-Hazards Preparedness Reauthorization Act of 2013,《PAHPRA法案》);2017年《第115-92号公法》(Public Law 115-92 of 2017)。
2013年《PAHPRA法案》对《FD&C法案》第564节做出修订, 在美国卫生与公众服务部部长发布紧急或面临威胁声明,证明紧急授权使用的必要性的情况下,允许FDA局长在卫生部长提出相关要求后,在某些紧急状态下,授权紧急使用未获批的医药产品,或已获批医药产品的未经批准用途。
FDA于2007年7月公布《医药产品紧急使用授权》(Emergency Use Authorization of Medical Products),建立了EUA的程序。2017年1月,FDA发布《行业与其它利益攸关方行业指南:医药产品紧急使用授权与相关权限》(Guidance for Industry and Other Stakeholders:Emergency Use Authorization of Medical Products and Related Authorities)。该指南是2016年4月发布的同名指南(草案)的最终版,同时替代之前发布的《医药产品紧急使用授权》(2007年7月发布)与《紧急使用授权问答》(2009年4月发布)。

▲医药对策产品(MCMs)(数据来源: 参考资料[22],药品康德内容团队制图)
在没有充分的、经批准的和可用的替代方法的情况下,FDA局长可签发EUA,允许在紧急状态下使用相关的MCM产品,用于诊断、治疗或预防化生放核剂(CBRN)引起的严重或威胁生命的疾病或病症。
由于紧急使用授权(Emergency Use Authorization,EUA)可能会是资源密集型过程,需要监管机构投入大量的人力、时间,因此, 《PAHPRA法案》对《FD&C法案》第564A节做出补充,建立简化机制,以促进涉及某些已获得FDA批准的MCM产品的准备和响应活动,而无需FDA签发紧急使用授权(EUA)。这些权限,仅适用于计划在CBRN紧急状态下使用的经过FDA批准的具备资质的相关医药产品,具体包括以下规定:
• 授权FDA,扩展经FDA批准的具有资质的,针对化生放核剂紧急状态库存备用的MCM产品的效期,并建立与此类扩展有关的适用条件,例如适用的储存、取样和标签方法;
• 允许FDA豁免在其它情况下适用的药品制造质量规范(CGMP)要求(例如:贮存或处理),以满足应急响应需求;
• 如果与发放MCM产品相关的州法律允许,或者在符合FDA签发的发放令(order)的情况下,允许在事实上的化生放核剂所引发的紧急事件期间,紧急发放MCM产品,不要求为MCM产品的所有接收者开具单独的处方, 也不要求在其它情况下,需要可能未获得配发许可的响应方提供的所有信息。
• 允许疾病预防与控制中心(CDC)制定、发布有关FDA批准的具有资质的相关产品使用条件的“紧急使用说明”(emergency use instruction,EUI)。
此外,《PAHPRA法案》对《FD&C法案》第505-1(k)节做出修订,授权FDA豁免针对CBRN紧急状态下的风险评估和降低策略(Risk Evaluation and Mitigation Strategy,REMS)要求。

图片来源: Pixabay
最后,《PAHPRA法案》对《FDA&C法案》第564B节做出补充,允许政府利益攸关方前置MCM产品,例如提前储备、部署预期将会获得FDA批准、批准临床研究使用或授予EUA的MCM产品,使得这些利益攸关方能够为事实上的CBRN紧急状态下可能的快速部署做好准备。
2. 相关豁免或放宽其它合规要求
2.1 CGMPs
FDA通常要求,获得EUA授权的产品将按照CGMP要求制造、贮存和配送;但是,在考虑具体情况与其它提议的方法后,可以根据具体情况,对EUA产品的合规要求予以放宽或豁免(参见《FD&C法案》第564(e)(3)节)。
2.2 处方要求
在紧急状态下,FDA可以在适当的范围内,豁免其它适用的处方要求(参见《FD&C法案》第564(e)(3)节)。例如,针对大规模应急响应的操作考虑,可能要求大量人员到集中位置,或者不是传统医疗照护情况下的地点接收医药产品,这些地点通常被称为“发放点”(points of dispensing,POD)。在这样的情况下,目标是尽快发放医药产品,保护公众健康。因此,在接受EUA授权的产品之前,如果要求所有接受者与执业机构互动沟通,可能不切实际。这些机构,包括一些可能会负责分配或管理某些或所有MCM产品的授权的发放机构。在考虑到对紧急状态的预期、实际情况以及应急响应的操作计划之后,FDA希望,根据实际情况,将这类豁免涵盖EUA。
2.3 REMS
FDA可能会依据所有会触发EUA的CBRN紧急状态,豁免其它情况下适用于REMS的其它要求(参见(《FD&C法案》第505-1(k)节)。如果确定需要豁免,则相关豁免可适用于所有REMS要素。

图片来源:Pixabay
3. 在没有EUA授权的情况下,紧急使用之前获批的具有资质的MCM产品
依据《FD&C法案》第564A节,允许FDA在没有EUA的情况下,促进某些涉及FDA批准的MCM产品采取紧急措施。该权限独立于《FD&C法案》第564节中的EUA权限。在过去,为了解决与MCM所涉活动有关的可能违反《FD&C法案》行为的担忧,FDA可采取下述措施:(1)行使与相关措施有关的执法自由裁量权;(2)签发EUA,以确保依据《PREP法案》中所规定的任何其它适用保护措施,仍涵盖这类相关的MCM产品。在此权限下使用的MCM产品,适用于《PREP法案》保护。
在一些情况下,FDA和CDC可能会协调依据《FD&C法案》第564A节授权的行动,包括发布紧急发放令,豁免cGMP,豁免REMS,扩展效期扩展效期,以及为特定MCM产品签发紧急使用说明(EUI)。
3.1 具有资质的产品
依据《FD&C法案》第564A节所规定的权限覆盖的紧急使用,仅适用于“具有资质”(如第564A(a)节中所定义)的医药产品(下文称为“具有资质的MCM产品”)。符合上述条件的MCM产品必须:
• 已获得FDA批准;
• 拟批准用于预防、诊断或治疗涉及化生放核剂(CBRN剂)所涉及的疾病或病症,或由用于此目的的产品所引起的严重或危及生命的疾病或病症;
• 旨在下述情况下使用:
• 国土安全部部长,国防部长或卫生与公众服务部部长确定紧急状态或重大紧急状态的可能性(参见《FD&C法案》(第564(b)(1)节(A),(B)或(C)(即,可能支持发布EUA声明的三项EUA决定之一);
• 由国土安全部部长依据《PHS法案》第319F-2节确定的重大威胁(参见第564(b)(1)节(D)分段中),足以影响国家安全或居住在国外的美国公民的健康与安全(例如,国土安全部(DHS)的重大威胁确定,也可能支持发布EUA声明)。
4. 在没有EUA授权的情况下扩展效期
如果有适当的科学研究结果的支持,并被FDA认可,储备用于化生放核剂紧急状态的经过FDA批准的具有资质的MCM产品,可以扩展效期。对“效期”的定义为,“通过适当的稳定性检验所确定的日期,以确保产品在使用时符合鉴别特性、规格、质量和纯度的适用标准”(《FD&C法案》第564A(b)(4)节)。
对于授予的所有的效期延长,FDA必须确定“产品的具体批次、批或其它单位”和扩展效期的时间。此外,FDA必须确定药品监管机构认为适用于保护公众健康的效期扩展的所有要求与条件,包括针对下述各项的要求或条件:
• 产品取样
• 贮存
• 包装或分包
• 运输
• 标签
• 产品使用者须知
• 记录保存
• 定期检测或复检
• 产品处置
《FD&C法案》第564A节中的效期扩展授权,适用于所有通过联邦效期延长计划(Shelf-Life Extension Program,SLEP计划)检测的具有资质的MCM产品。从上世纪80年代中期以来,FDA与SLEP计划的联邦合作伙伴合作;由国防部负责管理该计划,由FDA检测某些联邦储备的药品的稳定性,以评估和视具体情况延长此类产品的效期。依据《PAHPRA法案》规定增加的明确的效期延长授权,并不会取代常态化的联邦SLEP。但是,对于FDA授权扩展效期的具有资质的MCM产品来讲,依据《PAHPRA法案》规定增加的明确的效期延长授权,消除了相关CMC产品在合法地位上的任何不确定性,而不论FDA是否也对相关的CMC产品签发EUA。
FDA目前不建议对SLEP计划,或通过SLEP计划测试的产品的效期延长程序,进行任何更改。对于在SLEP计划中测试的药物,联邦参与者应继续使用既定流程提出延长具有资质的MCM产品效期的请求。FDA正在考虑对未在SLEP计划中进行测试的合格产品扩展效期的方法。政府利益攸关方应通过电子邮件或致函FDA的相关中心,和反恐与防范新出现威胁办公室(Office of Counterterrorism and Emerging Threats,OCET)联络人。
尽管FDA可能会依靠第564A条授权扩展效期而不签发EUA,但如果对接近或超过其标示效期的产品请求EUA授权,则FDA可以考虑将效期扩展延伸至所授予的EUA。
4.1 总则
在不签发EUA的情况下,FDA可能会授权许可对在其它情况下,针对制造、加工、包装环节适用的CGMP要求偏差,或持有符合资质的FDA已批准产品的环节的CGMP要求的偏差(参见《FD&C法案》第564A(c)节)。依据《FD&C法案》中的相关规定,适用于CGMP豁免的产品,不会被视为掺杂使假或冒牌(adulterated or misbranded)。
包括《FD&C法案》第501或520(f)(1)节下的规定,或依据第520(f)(2)节规定的具有资质的产品的适用条件。
尽管FDA可能会在不签发EUA的情况下依靠《FD&C法案》第564A节豁免相关的CGMP要求,但是,如果同时对要求给予CGMP豁免的产品请求EUA授权,则FDA可以考虑豁免CGMP要求,并施加与EUA相关的条件。
4.2 申请和签发程序
FDA可能会主动发布豁免,但FDA预期主动发布豁免的情况会很少。由于对紧急状态的响应和对化生放核剂紧急状态做出响应的其它要求,将会推动豁免,因此FDA希望,在大多数情况下,豁免将基于来自于政府利益攸关方,或其它利益攸关方的请求。打算在化生放核剂紧急状态下使用的政府利益攸关方或产品制造商,可以基于确实有必要豁免的实际或预期的应急响应活动,提交针对有资质产品的CGMP豁免请求。FDA建议,仅在与相关的政府利益攸关方(例如CDC和管辖权相邻接的政府官员)磋商之后,才提交请求,这些利益攸关方,最终可能成为涉及化生放核剂紧急状态或MCM产品(或最终可能是涉及化生放核剂的协调或相关响应工作的一部分,或MCM产品的协调行动或相关行动的参与者。),在缺乏正当理由的情况下,为保持响应的一致性,FDA预期,对于同一MCM产品,或用于化生放核紧急状态的产品,不会给予多项CGMP豁免。类似的,如果FDA已经在全美国范围内针对同一MCM产品发出了相同类型的豁免,通常不会再根据个别州的请求予以豁免。同样,如果FDA同时从多个州或联邦政府合作伙伴那里收到针对特定MCM产品的CGMP豁免请求,则FDA通常将发布一项豁免(如果适当)。事先考虑和协调,对于确保适当的一致性,避免不必要的重复至关重要。
FDA将依据《FD&C法案》第564A(c)节的要求,评估CGMP豁免请求。当FDA根据现有信息得出结论,有理由发布豁免,推进针对化生放核剂紧急状态的应急响应或备灾工作时,可以发布豁免。豁免请求应包括下述信息:
• 所涉及医药产品的鉴别特性与数量(例如,在适当情况下的产品名称;剂型和规格;剂量数、单位、批次或其它单位;单位/批次、标识);
• 制造商的名称,地址和联系信息;
• 产品的FDA申请文件编号(例如新药申请(NDA),生物制品许可申请(BLA),新药临床试验申请(IND),器械临床试验申请(IDE));
• 计划使用该产品的事实上的或潜在的化生放核剂紧急状态;
• 将会偏离或可能会偏离CGMP要求的预期条件(例如存贮、处理、运输,包装),将请求豁免相关条件,包括偏差的原因,以及预期持续时间;
• 有关偏差对产品安全性或功效的潜在影响的可用信息(例如规格、纯度、质量)。
FDA可能会要求提供其它信息,以对请求做出评价,并决定是否予以豁免。依据《FD&C法案》第564A(c)节,对CGMP要求的豁免可以(1)在适当情况下,独立于FDA的任何其它措施;(2)依据《FD&C法案》第564A(d)节,涵盖在紧急发放令中。
通过电子邮件或致函FDA的相关中心和反恐与防范新出现威胁办公室(OCET)联络人,提交针对具有资质的MCM产品的CGMP豁免请求。
4.3 在没有EUA授权情况下的MCM产品紧急发放
紧急发放“包括但不限于“大量发放”MCM产品的公共卫生响应活动。在《FD&C法案》第503(b)或520(e)节的要求范围之外,依据该法案第564A(d)节,允许经FDA批准的具有资质产品的紧急发放。在下述情况下,相关权限覆盖在没有针对每个接收者的个人处方的情况下,发放此类产品。这种情况,通常称为“大批量发放”(mass dispensing):(1)发放相关产品的所在州的州法律允许依据《FD&C法案》第564A(d)(2)(A)节所规定的紧急方法;或(2)依据FDA颁布的紧急发放令发放(参见《FD&C法案》第564A(d)(2)(B)节)。这种简化的机制,允许开展相关的应急响应活动,涉及满足紧急公共卫生需求所需的紧急发放策略,但在其它情况下,这里特指的紧急发放活动,可能有违《FD&C法案》中规定的其它情况下的处方要求。与第564A节中的其它规定一样,FDA可以颁布紧急发放令,允许在不颁布EUA的情况下,紧急发放具有资质的MCM产品。依据《FD&C法案》,依据法案第564A(d)节发放的产品(即依据州法律或FDA紧急发放令),将不会被视为未经批准、掺杂使假或冒牌。
尽管FDA可能依照《FD&C法案》第564A节的规定,允许在不签发EUA的情况下,紧急发放FDA批准的产品,但对于同时需要紧急发放的产品请求EUA授权的情况,则FDA可以考虑豁免处方要求。在考虑EUA的情况下,附加条件。
(1)签发紧急发放令的程序
各州可能已经制定了有助于紧急发放具有资质的MCM产品的规定,或者可以选择采取相关法律行动(例如通过法律,发布紧急令),来促进紧急发放具有资质的MCM产品。
紧急发放《FD&C法案》第564A(d)节为FDA提供了一种机制,可通过这一机制,颁布允许紧急发放具有资质的MCM产品的发放令(即紧急发放令),以填补各州法律中的空白,确保在州内和州际范围内开展充分一致的应急响应。FDA可能在颁布紧急状态之前,或在紧急状态期间颁布发放令。但是,要获得针对可能违反《FD&C法案》第564A(d)节规定的保护措施,只有在相关政府利益攸关方确定的紧急状态下(而不是在紧急状态之前),才能发放具有资质的MCM产品。
根据MCM产品、应急响应计划和运营需求的可用信息,FDA认为可以合理地紧急发放具有资质的FDA批准的产品,因此颁布紧急发放令。FDA预期政府利益攸关方将提交紧急发放令的请求。但是,在适当情况下,如果FDA认为无需发出此类请求即可发出令,FDA将视情况通知相关的政府利益攸关方,例如,卫生部防备和响应助理部长办公室(Office of the Assistant Secretary for Preparedness and Response,ASPR),疾控中心(CDC),本土安全部(DHS),国防部(DoD),以及相关的地方当局。
(2)联邦请求
FDA期望联邦政府的利益攸关方将发起与联邦维护或联邦控制的MCM有关的任何请求,并在可能的情况下,将考虑在州、地方、部落和地区管辖范围内的所有司法管辖区内,开展同一MCM产品的紧急发放活动。例如,如果CDC的战略性国家储备(Strategic National Stockpile)、州或地方辖区,都储备了一种用于暴露后预防吸入性炭疽的抗生素,那么,FDA预期CDC会请求该抗生素的紧急发放令的情况下,关注所有其它的政府利益攸关方的储备。FDA同时期望,寻求紧急发放令的联邦利益攸关方,或其它情况下发放令所针对的联邦利益攸关方,将在必要时与其它政府利益攸关方沟通,以确保应急响应协调一致。
(3)非联邦请求
FDA还期望收到与仅由非联邦政府利益攸关方,例如,各州或独立维护或控制MCM储备的主要都市区的公共卫生官员,以解决在独立与联邦资产之外的情况下,调配此类资产的可能性。FDA强烈建议,仅在与相关联邦政府利益攸关方(例如CDC),以及与相关的其它政府利益攸关方(例如,邻近司法管辖区的官员)协商后,或可能参与协调或与同样的化生放核剂或MCM产品的相关响应工作之后,才提交此类请求。
(4)请求的内容
FDA预计紧急发放令的请求,将包括以下信息:
• 所涉及的化生放核剂;
• 需要颁布发放令的获得FDA批准的产品(包括产品名称、制造商、数量、剂型、规格、给药方案,批次或批号,效期与其它所有标识信息);
• 产品的预期用途;
• 所涵盖的司法管辖区(例如,全国,州,地区);
• 下达发放令的紧迫程度;
• 产品来源(例如,国家战略储备(Strategic National Stockpile,SNS),州或地方MCM产品库存,以及其它多个来源);
• 拟定的发放令持续期限;
• 相关的政府利益攸关方在预期响应中的作用。
FDA也可能要求提供附加信息,以评估相关请求并做出决定。相关的附加信息包括:预期的有关发放策略,发放地点,发放人员,接受者筛选的信息,或在紧急状态下如何告知医疗保健专业人士或授权的发放者和接受者有关产品安全性、功效和使用的信息。例如,相关产品是否应附上CDC签发的紧急使用说明(emergency use instruction, EUI)。
提交请求的流程:通过电子邮件或致函,向确定的相关中心和FDA反恐与新出现威胁办公室(Office of Counterterrorism and Emerging Threats,OCET)联络人提交针对具有资质的MCM产品的紧急发放令的请求。
(5)紧急发放令的范围和条件
FDA颁布的紧急发放令,将授权进行紧急发放,但不能直接指示或要求进行紧急发放;政府利益攸关方通常将负责确定何时根据发放令中指定的条件开始紧急发放。FDA预期,在大多数情况下,如果政府利益攸关方有理由认为,接受者组成已知、怀疑或可能即将暴露于所发放令所确定的化生放核剂中而存在需求,那么紧急发放令将允许在所有情况下发放。FDA还预期,政府利益攸关方在紧急状态响应中所设想的所有发放,都将在可能的范围内,涉及有执业医疗保健专业人士发放相关产品的指导。但是,依据《FD&C法案》第564A(d)节节颁布的紧急发放令也可能会指出,在某些情况下,如果获得产品授权,则可能不能得到在其它情况下一样,直接或立即得到执业医护人员的介入或指导;此外,作为化生放核事件期间官方政府应急计划的一部分,紧急发放令可能会授权其他人化生放核剂事件进行发放。
FDA可以在紧急发放令中指定谁负责联系可能参与对该令所涵盖的化生放核剂事件做出响应的其它政府利益攸关方,以(1)确保相关政府应急响应计划得到适当协调或修正。(2)针对具体情况,具体规定不同的条件或附加条件,包括支持签发紧急发放令请求而提供的信息,例如,适应或解决特定的响应策略或操作注意事项。(3)在适用情况下,豁免《FD&C法案第654A(c)节中规定的CGMP豁免项。
在适当的情况下,FDA也可以与CDC协调,以便FDA颁布紧急发放令,同时CDC发出同一MCM产品的紧急使用说明(EUI)。
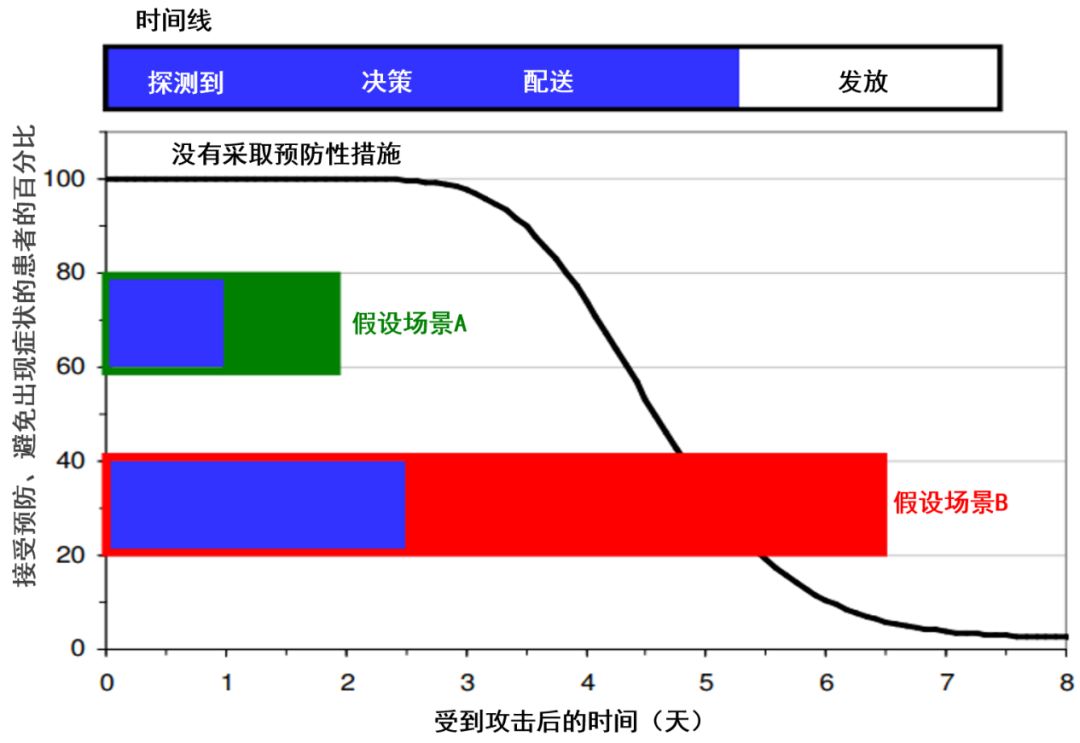
▲响应速度至关重要! 4Ds(detect, determination, distribute, dispense;探测、决定、配送、发放)的两个假设场景。4Ds是决定如何通过大规模预防来减轻蓄意释放炭疽造成的威胁的关键。图片来源:参考资料[32,33]
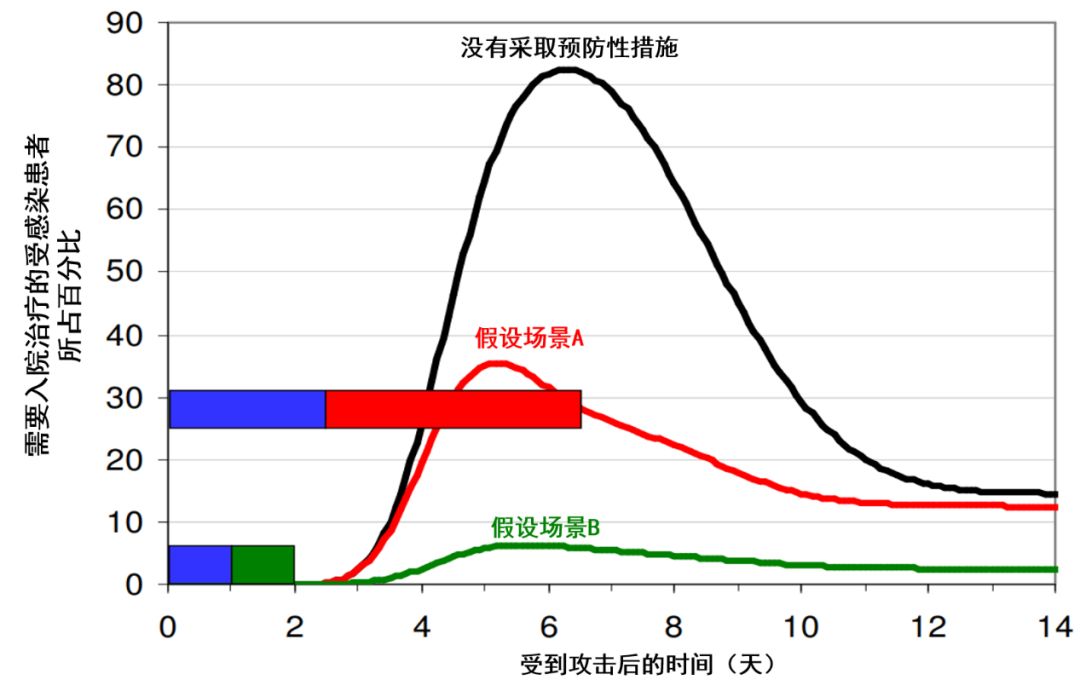
图片来源:参考资料[34,35 ]
(6) 紧急发放令的期限
在大多数情况下,在化生放核事件发生之前,FDA出于备灾目的而签发的紧急发放令,在FDA修订该发放令之前,或者被后续的FDA发放令废除之前,前述的出于备灾目的而提前签发的发放令将一直有效。FDA可能会指定紧急发放令的期限(例如为期1年),但可以适当延长期限。
(7) 在没有EUA授权情况下的紧急使用说明
CDC可以制定、发布和传播有关具有资质的MCM产品的经过批准、许可的使用条件的特别紧急使用说明(emergency use instruction,EUI)(参见《FD&C法案第564A(e)节)。紧急使用说明(EUI)的目的,类似于过去的EUA中已授权的“使用说明书”(fact sheet),并可能面向医疗保健专业人士、授权的具有资质的MCM产品发放者或接收者。可以在化生放核剂事件发生之前和响应期间,制定和传播紧急使用说明(EUI)。
在过去的公共卫生紧急事件中,大家会担心,MCM产品的使用说明,甚至是那些经FDA批准用于相关疾病或病症的MCM产品(例如,用于暴露后预防吸入性炭疽的药物强力霉素),会因为与FDA批准的产品标签不同而违反《FD&C法案》,从而使依据《PREP法案》另行规定的任何责任保护无效。根据相关规定签发紧急使用说明(EUI)时,相关的签发,并不会剥夺在其它情况下相关产品所适用的《PREP法案》保护。因此,紧急使用说明(EUI)的规定,为CDC提供了更大的灵活性,可以为CDC针对相关疾病或病症,制定和发布已获得FDA批准、许可的MCM产品的紧急使用说明(EUI),并没有进一步的限制。FDA和CDC将此规定解释为允许制定紧急使用说明(EUI),该说明阐述了如何将已获批药品用于被批准使用的疾病或病症,但具体使用方式可能会偏离或超出FDA批准的标签说明。另一方面,该紧急使用说明(EUI)中,不允许有任何描述已获FDA批准的产品用于未获批的疾病或病症的内容。
5. 政府在MCM产品中的前置作用
《PAHPRA法案》新增加的一项规定,允许在计划将产品保存,供紧急使用时备用(而非使用),无需FDA批准就前置MCM产品(参见《FD&C法案》第564B节),使利益攸关方可以为在紧急状态下快速部署MCM产品做好准备。该授权允许政府利益攸关方或代表政府利益攸关方者(例如政府利益攸关方的代理人),在不违反《 FD&C法案》的前提下,将用于紧急用途的医药产品引入州际贸易中,例如库存或运输。不论产品的监管状态如何,即没有IND,IDE或FDA的任何其它认可,但预期将在适当的监管机制下,允许使用(即FDA批准,授权或用于临床研究)。
前置MCM产品的权限,适用于计划用于紧急用途的所有类别的医药产品,包括那些已获批、未获批用于临床研究,或授权EUA的医药产品。但是,只有在这些机制之一在获得允许的情况下,事实上存有MCM产品,但不用于诊断、治疗或预防化生放核剂相关疾病或病症的MCM,政府利益攸关方才可以诉诸于此权限。这意味着,举例来说,即使政府利益攸关方可以储存未经批准的MCM,也可能需要采取其它措施,以确保在需要时可以使用任何前置的MCM产品。因此,FDA建议政府利益攸关方也考虑,并在适当情况下启动步骤,以确保能够获得批准,或者IND/IDE或EUA已经就位,或者在必要时可以很容易地就位。
那些诉诸于此条款的相关机构,必须保存能够证明相关产品符合紧急使用条件的文件,包括反映政府利益攸关方最初持有和不使用MCM产品的看法的记录,直到在适当的监管机制下,使用相关的MCM产品为止。目前,FDA未具体指定任何与前置MCM产品相关的其它记录保存方法。然而,FDA建议,在可行的范围内,政府利益攸关方应保持足够的记录或其它信息,以便能够容易地识别其前置的MCM产品(例如,按产品名称,制造商名称,剂型和规格,持有量,批号),以及这些MCM产品的发放、贮存和最终处置。对于未经FDA批准的产品,该信息可能将成为需要维护才能在IND/IDE或EUA下使用的记录的要素。此外,此信息将有助于最大程度地减少错误识别、遭遇盗窃、其它损失,以及产品变质的风险。例如,由于缺乏相关产品状况的信息,政府利益攸关方无法确认已正确贮存的MCM产品,是否符合EUA的使用条件或产品效期的其它适用扩展期限。
6. 联邦法优先原则(Preemption)
FDA预计,如果FDA依据《FD&C法案》第564、564A和564B节采取相关行动, 同时各州对未获批的医药产品或相关用途未经批准的已获批医药产品的运输、保存、发放、管理或标签有规定,这样的情况,可能会引起联邦法律与州法律之间的冲突。依据《美国宪法》的至上条款(Supremacy Clause),美国宪法第六章第二段规定,该宪法以及依据该宪法所制定的合众国法律,以及依据合众国的权力已缔结或将缔结的一切条约,都是全国最高法律(supreme law of the land),对于与之冲突的州宪法或法律,享有优先权。在之前的多个相关的法庭判例中,裁定州立法要求和州普通法规定的义务无效。根据隐含冲突优先权的法律原则,相关法院认为,在不可能同时遵守联邦和州法律的情况下,或者在州法律“成为实现和执行国会的全部宗旨和目标的障碍时,州法律将被取代”。依据该判例法,第13132号行政令第4(a)节规定:“[相关机构]应解释……联邦法规仅在法规中包含明确的优先原则条款,或有其它明显证据表明,国会打算取代(preempt)州法律,或在行使州权力与根据联邦法规行使联邦权力相抵触的情况下,才能取代州法律。”
FDA认为,依据《FD&C法案》第564节发布的EUA的条款和条件,优先于州或地方法律、立法要求和普通法责任。在依据《FD&C法案》宣布紧急状态时,这样的规定,对在授予EUA范围内的医药产品,施加了不同或额外的要求。类似地,依据《FD&C法规》第564A节发布的发放令或豁免,以及依据《FD&C法规》第564B节开展的前置活动,优先于州或地方法律(包括立法要求和普通法义务),对依据《FD&C法规》第564A或564B节授权开展的行动,施加不同或额外的要求。
在所宣布的紧急状态或紧急威胁的范围内,相关的州或地方法律,可能会在某种程度上施加不同于或超出EUA对特定医药产品的要求。例如,对处方、发放、管理或标签的要求;该法律“对实现和执行国会的全部宗旨和目标构成障碍”,并“与行使依据《FD&C法案》第[564]节规定的联邦授权相冲突。”相同的理由,适用于依据《FD&C法案》第564A节颁布的发放令或豁免,以及依据《FD&C法案》第564B节开展的MCM前置。
受影响的州法律,可能包括但不限于用于管理研究临床研究用医药产品的法律,例如知情同意、需要伦理审查委员会批准的法律,以及管理医药产品处方或发放的法律,例如在某些情况下,限制开具处方或发放医药产品的相关人员的法律。
此外,《PREP法案》明确规定了与某些MCM活动相关的侵权行为赔偿责任(tort liability)豁免权,优先于与《PREP法案》所适用的相关对策的任何要求不同或存在冲突的相关州法律,也优先于与依据《FD&C法案》要求所适用的任何问题不同或相冲突的州法律。 这样的情况,包括为符合EUA的条款,依据《FD&C法案》第564A节颁布的发放的令或要求而采取的行动,依据《FD&C法案》第564B节对MCM产品的前置,IND,IDE,或FDA对MCM产品的任何批准。
在相关的紧急状态下,至关重要的是,必须严格遵守EUA或依据《FD&C法案》第564A节颁布的发放令或豁免条件,即FDA确定为保护公众健康所必需或适用的条件,以及附加条件。在某些情况下,FDA希望依据EUA开展活动的人员,也遵守被取代的州法律中包含的要求,FDA希望将此类要求纳入EUA的条款和条件。
同样,依据第《FD&C法案》第564A(b)节做出的扩展效期;依据《FD&C法案》第564A(c)节豁免针对CGMP的要求;以及依据第564A(d)节规定,允许紧急发放的FDA颁布的发放令,旨在通过在紧急状态下,公众可以快速使用可能拯救生命的医药产品,实现保护公众健康的目标。管辖CGMP要求或FDA扩展效期,CGMP豁免或紧急发放令所涵盖的产品发放的州法律,如果施加不同或附加的条件,将限制对FDA行动所覆盖的具有资质的相关产品的获取,会被认为是对实现上述目标的障碍。因此,FDA认为,在FDA对效期扩展、CGMP豁免或紧急发放令的管辖范围内,如果相关的州法律对FDA发放令所覆盖的发放产品,或依据上述相关法案的MCM产品前置,施加了更多限制条件或要求,那么《FD&C法案》第564B节将具有优先权。
但是,如上所述,州法律可能允许紧急发放具有资质的MCM产品。依据《FD&C法案》第564A(d)节,对于政府利益攸关方在没有处方或不遵守其它可能适用的其它处方要求的情况下,提供紧急发放,这类相关法律可以提供另一种依据。如果相关框架在提供对相关发放令所涵盖的FDA批准产品的获得权限方面,不比FDA颁布的相关发放令更具限制性,在这样的情况下,FDA依据《FD&C法案》第564A(d)节颁布的发放令,无意取代上述相关框架。
7. 责任保护
除了所有适用的优先原则以外,依据《FD&C法案》第564、564A和564B节,并没有为在这些授权下进行任何活动的利益攸关方授予明确的责任保护(liability protection)。
但是,《PREP法案》可能规定免除与此类权限下授权的活动有关的侵权赔偿责任(tort liability)。更为具体地讲,《PREP法案》授权卫生与公众服务部部长发布声明(称为“PREP法案声明”),该声明规定,对与参与开发、制造、检测、配送、管理、使用此类对策有关的实体和个人,对相关索赔享有豁免权(蓄意的不当行为除外)。包括发布《PREP法案》声明授权在内的《PREP法案》授权,属于卫生与公众服务部部长,并没有委托给FDA。
《PREP法案》的责任保护,适用于法规所定义的“所涵盖的对策”。这些所涵盖的对策,包括由FDA批准、许可的医药产品;IND或IDE申请获批用于临床研究用途;依据《FD&C法案》第564节,授权用于紧急状态;或依据《FD&C法案》第564A和564B节,允许以其它方式保存或使用。之前授予EUA的部分原因,是为了解决与MCM产品相关的某些活动可能违反《FD&C法案》规定的相关问题,这些问题会损害在其它情况下适用的《PREP法案》的保护。《PAHPRA法案》在“所涵盖的对策”的定义中,增加了《FD&C法案》第564A和564B节的相关内容,部分原因是为了保留这些本应适用的《PREP法案》的保护措施。
8. EUA涉及的医药产品进出口
尽管获得EUA授权,并不意味着相关的医药产品获得FDA批准,但在EUA声明的效期内,根据EUA授权用于紧急使用的医药产品,可能会被引入州际贸易。因此,视相关的EUA授权条款和条件,可以依据《FD&C法案》(参见美国法典汇编第21编第381节,21 U.S.C. 381)的第801节合法进出口。相关的EUA授权书,可作为使用的文件或证明,证明该产品可以合法进口或出口。
在过去的具体实践中,FDA收到EUA授权请求,主要将临床研究用的相关产品主要在国外用于紧急使用(例如在埃博拉危机期间,在西非使用)。在这些情况下,是否签发EUA的评估与任何其它紧急用途的评估相同:FDA必须确定,是否所请求的EUA决定、声明和标准能够符合相关要求,并考虑在国外环境中遵守必要和适当的使用条件是否可行或切实可行。
免责声明:本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。
参考资料:
[1] 药明康德内容团队. 美国FDA如何开展医药产品紧急使用授权?Feb 27, 2020. Retrieved Feb 28, 2020 from http://dy.163.com/v2/article/detail/F6FA2SNM05349C3I.html
[2] FEDERAL FOOD, DRUG, AND COSMETIC ACT. [As Amended Through P.L. 116–94, Enacted December 20, 2019] Retrieved Dec 22, 2019 from https://legcounsel.house.gov/Comps/Federal%20Food,%20Drug,%20And%20Cosmetic%20Act.pdf
[3] PUBLIC HEALTH SERVICE ACT. [As Amended Through P.L. P.L. 116–94, Enacted December 20, 2019]. Dec 20, 2019. Retrieved Dec 21, 2019 from https://legcounsel.house.gov/Comps/PHSA-merged.pdf
[4] 108th Congress. Project BioShield Act of 2004. Jul 21, 2004. Retrieved Oct 2, 2012 from https://www.congress.gov/108/plaws/publ276/PLAW-108publ276.pdf
[5] 119th Congress. PUBLIC READINESS AND EMERGENCY PREPAREDNESS ACT. [119 STAT. 2818 PUBLIC LAW 109-148-DEC. 30, 2005]. Dec 30, 2005. Retrieved Oct 3, 2012 from https://www.hrsa.gov/sites/default/files/gethealthcare/conditions/countermeasurescomp/covered_countermeasures_and_prep_act.pdf
[6] 113th Congress. Public Law 113–5. 113th Congress Pandemic and All-Hazards Preparedness Reauthorization Act of 2013 (PAHPRA). Mar 13, 2013. Retrieved Feb 17, 2020 from https://www.govinfo.gov/content/pkg/PLAW-113publ5/pdf/PLAW-113publ5.pdf
[7] 115th Congress. PUBLIC LAW 115–92. Dec 12, 2017. Retrieved Feb 17, 2020 from https://www.congress.gov/115/plaws/publ92/PLAW-115publ92.pdf
[8] 113th Congress. Pandemic and All-Hazards Preparedness Reauthorization Act of 2013. Mar 13, 2013. Retrieved Jan 2, 2020 from https://www.congress.gov/113/plaws/publ5/PLAW-113publ5.pdf
[9] 除非另行说明,否则术语“批准的产品”和“FDA批准的产品”,指依据《FD&C法案》第505、510(k)或515节,或《公共卫生服务法案》PHS第351节获得批准、许可的产品。在本文件范围内,“未经批准”的产品,指依据FD&C法案第505、510(k)或515节,或《PHS法案》第351节,未予批准、许可,或未予许可用于商业流通的产品;“已获批产品未经批准的使用”,指依据本规定批准、许可的产品,但相关的特定用途,并非该产品获批、获许可的用途。参见《FD&C法案》第564(a)(2)节。
[10] 除非另行说明,否则术语“获批产品”和“FDA批准的产品”,指依据《FD&C法案》第505、510(k)或515节,或《公共卫生服务法案》(PHS法案)第351节获得批准、许可的产品。在相关指南的范围内,“未经批准”的产品,指依据FD&C法案第505、510(k)或515节,或《PHS法案》第351节,未予批准、许可,或未予许可用于商业流通的产品;“已获批产品未经批准的使用”,指依据本规定批准、许可的产品,但相关的特定用途,并非该产品获批、获许可的用途。参见第《FD&C法案》第564(a)(2)节。
[11] DHHS. FDA. Office of the Commissioner, Office of the Chief Scientist, Office of Counterterrorism and Emerging Threats. Emergency Use Authorization of Medical Products and Related Authorities, Guidance for Industry and Other Stakeholders. Jan, 2017. Retrieved Dec 30, 2019 from https://www.fda.gov/media/97321/download
[12] Anna Abram, Denise Hinton. FDA Protecting the Nation Through Medical Countermeasures. April 29, 2019. Retrieved May 3, 2019 from https://www.fda.gov/news-events/fda-voices-perspectives-fda-leadership-and-experts/fda-protecting-nation-through-medical-countermeasures
[13] 在应用于医疗器械时,称为“质量体系法规”要求。
[14]在相关指南范围内,术语“收件人”指MCM产品的使用对象。
[15] U.S. Department of Health and Human Services, Delegation of Authority of section 564A(e) of the Federal Food, Drug, and Cosmetic Act. Dec 16, 2013. Retrieved Feb 20, 2020 from http://www.fda.gov/downloads/EmergencyPreparedness/Counterterrorism/MedicalCountermeasures/MCMLegalRegulatoryandPolicyFramework/UCM510446.pdf
[16] 依据《FD&C法案》第564A(c)节,单独授权FDA,对于不授予EUA的情况下,对于获得FDA批准的,有资质的相关产品,可以有权准许与其它情况下适用的CGMP所要求的制造、加工、包装、保存条件存在偏差。
[17] FDA同时预期,根在考虑预期或事实上的紧急状态和响应操作计划之后,根据实际情况,在EUA中纳入这类豁免。
[18] 有关REMS的详细信息,请参见FDA行业指南(草案)Guidance for Industry Format and Content of Proposed Risk Evaluation and Mitigation Strategies (REMS), REMS Assessments, and Proposed REMS Modifications. Oct, 2009. Retrieved Nov 2, 2017 from http://www.fda.gov/ucm/groups/fdagov-public/@fdagov-drugs-gen/documents/document/ucm184128.pdf
[19] FDA. Format and Content of a REMS Document Guidance for Industry. Guidance for Industry (Draft Guidance). Oct, 2017. Retrieved Nov 2, 2017 from https://www.fda.gov/media/77846/download
[20] 参见42 U.S.C. 247d-6d.
[21] 参见42 U.S.C. 247d-6d(i)(1)(C), (i)(7)(B)(iii).
[22] 正如之前EUA相关的内容所述,FDA已依据319F-2节对实质性威胁识别确定做了解释,以适用于居住在国外的美国公民的健康和安全,即使该规定并不专门针对美国以外的公民。因此,在适当的情况下,可以行使第《FD&C法案》第564A(b),(c)和(d)节节,以及第505-1节所规定的应急机构的基础,确定重大威胁,保护居住在海外的美国公民。
[23] FDA. Expiration Dating Extension. Feb 24, 2020. Retrieved Feb 25, 2020 from https://www.fda.gov/emergency-preparedness-and-response/mcm-legal-regulatory-and-policy-framework/expiration-dating-extension
[24] 参见《FD&C法案》第564A(b)(2)(A)节.
[25] 参见《FD&C法案》第564A(b)(2)(B)节.
[26] 参见《FD&C法案》第564A(b)(2)(C)节.
[27] 有关到期日期扩展名的其他信息,请参见http://www.fda.gov/EmergencyPreparedness/Counterterrorism/MedicalCountermeasures/MCMLegalRegulatoryandPolicyFramework/ucm411446.htm.
[28] FDA. Office of Counterterrorism and Emerging Threats (OECT). Jan 10, 2020. Retrieved Feb 22, 2020 from https://www.fda.gov/about-fda/office-chief-scientist/office-counterterrorism-and-emerging-threats
[29] ”紧急发放“包括但不限于“批量发放”MCM产品的公共卫生响应活动(例如通过发放点发放)。
[30] 紧急发放可能包括在没有个人处方的情况下发放,或者在没有FDA另行要求的所有信息(例如发放者的姓名和地址,处方者的姓名,序列号等)的情况下发放不完整的处方。(参见《美国法典汇编》第21编(21 U.S.C.)第503(b)(2)节)。这种情况,还可能包括由非医疗保健专业人员发放。
[31] 特定的州法律规定或行动,是否足以允许政府利益攸关方在相关州州内预期的紧急发放策略,在很大程度上,取决于对该州法律的解释,这是首先应交给相应的法律权威的问题,例如在相关管辖权范围内(例如,州总检察长管辖权范围内)。为确保清楚阐明,并可能增加州法律、法规、命令或其它允许紧急发放的法律行动在法律上具有足够的可能性,建议采取这类行动,说明与FDA计划在紧急发放令中阐明的内容,具有相同的资质、范围、期限和其它要素。
[32] Sid Baccam. Anthrax: A Current Threat. Mar 3, 2008. Retrieved Feb 20, 2020 from http://nationalacademies.org/hmd/~/media/Files/Activity%20Files/PublicHealth/MedPrep/Baccam.pdf
[33] IOM. Dispensing Medical Countermeasures for Public
Health Emergencies: Workshop Summary. Washington, DC: The National Academies. 2008. Press. https://doi.org/10.17226/12221
[34] Sid Baccam. Anthrax: A Current Threat. Mar 3, 2008. Retrieved Feb 20, 2020 from http://nationalacademies.org/hmd/~/media/Files/Activity%20Files/PublicHealth/MedPrep/Baccam.pdf
[35] IOM. Dispensing Medical Countermeasures for Public
Health Emergencies: Workshop Summary. Washington, DC: The National Academies. 2008. Press. https://doi.org/10.17226/12221
[36] 依据《FD&C法案》第564A(e)节,允许指定的卫生与公众服务部(HHS)官员制定和发布紧急使用说明(EUI)。尽管EUI权限是《FD&C法案》的一部分,但在FDA、CDC与ASPR的联合推荐下,HHS部长将创建EUI的权限授予CDC主任(或其指定人)。允许CDC制定和传播EUI,有助于充分发挥CDC在提供应对事件的治疗建议,并促进外部利益攸关方的紧急响应方面的临床专业知识,以及其在第一线管理可能最需要EUI的医疗产品的SNS中的作用。请参阅FDA官网上的FDA和CDC关于EUI协调的谅解备忘录,网址:http://www.fda.gov/aboutfda/partnershipscollaborations/memorandaofunderstandingmous/domesticmous/ucm487464.htm.
[37] 在没有CGMP豁免的情况下,政府利益攸关方或代表其行事的个人,应继续存储和处理预定的MCM产品,支持根据CGMP标准使用相关的MCM产品。
[38] 尽管FDA认为联邦法优先原则适用于此,但FDA承认,这是法律上存在争议的领域。由于建议某些州采取相关应对方案的律师,可能会持此与处表达的观点相异的观点,因此,FDA鼓励相关州的(紧急使用)计划,向其法律顾问咨询有关他们是否认为相关的州是否需要采取补充性法律行动,以确保其相关州法律不会与联邦政府可能依据《FD&C法案》第564和564A节采取的行动,或可能会影响依据《FD&C法案》第564B节所规定的前置行动发生冲突。如果认为有必要采取相关的州行动(方案),则必须将相关州法律的任何必要变更,或实施相关的州法律,以允许以及这些相关条款,采取紧急准备行动的必要步骤确定为相关州应急计划的一部分,这一点很重要。
[39] 当FDA依据《FD&C法案》第564A(c)节发布CGMP要求豁免,或依据《FD&C法案》第564A(d)节规定,发布准许紧急发放令时,也可能会出现此类问题。
[40]Medtronic诉Lohr案,518 U.S. 470,503(1996);Cipollone诉Liggett Group,Inc.案,505 U.S. 504,521(1992)。基于同样的理由,国家法规和地方法规也将被予以优先考虑。
[41] The Constitution of the United States of America. Retrieved Feb 26, 2020 from https://www.law.cornell.edu/constitution/index.html
[42] ibid. “This Constitution, and the laws of the United States which shall be made in pursuance thereof; and all treaties made, or which shall be made, under the authority of the United States, shall be the supreme law of the land; and the judges in every state shall be bound thereby, anything in the Constitution or laws of any State to the contrary notwithstanding.”
[43] 薛波主编. 潘汉典总审定. 元照英美法词典. 法律出版社. 2003年. 北京.
[44] 见亚利桑那州政府诉联邦政府,132 S. Ct。2492、2501、2505、2507(2012);Crosby诉国家贸易委员会案,530 U.S. 363,373(2000);Geier诉American Honda Motor Company,Inc.案,529 U.S. 861,873(2000);Hines诉Davidowitz案,312 U.S. 52,67(1941).
[45] Exec. Order No. 13132, 64 FR 43255. August 4, 1999. Retrieved Feb 20, 2020 from https://www.govinfo.gov/content/pkg/FR-1999-08-10/pdf/99-20729.pdf.
[46] 参见42 U.S.C. § 247d-6d(b)(8).
[47] 一项特定的州法律规定或行动,是否足以允许州或地方政府利益攸关方预期在其州内实施紧急发放策略,很大程度上取决于对相关州法律的解释,应首先寻求直接由相关管辖范围内适当的法定授权人(例如州总检察长)处理。为确保相关问题得以明确,并可能增加州法律、法规、命令或其其它允许紧急发放的法律行动被视为足够的可能性,建议此类行动采取与FDA相关计划采用的相同资质、范围、期限与其它要素,如上所述。
[48] 参见42 U.S.C. 247d-6d. For information on the PREP Act, see HHS’s website at 有关《PREP法案》的相关内容,请访问HHS网站:http://www.phe.gov/Preparedness/legal/prepact/Pages/default.aspx.
[49] 参见42 U.S.C. 247d-6d(b).
[50] 参见42 U.S.C.247d-6d(i)(1) and (7).
[51] 21 U.S. Code § 381. Imports and exports. Retrieved Feb 20, 2020 from https://www.law.cornell.edu/uscode/text/21/381
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..