翻译:PharmLink华平 来自:蒲公英
2020年2月19日,FDA发布2019年仿制药办公室年度报告。
FDA表示,仿制药在美国处方中占90%以上,安全、有效、高质量的仿制药在美国医疗体系中起着至关重要的作用。可负担的药物是公共卫生的重中之重,仿制药的竞争可以明显低药物价格。
仿制药:竞争可以帮助降低价格

通过使更多的药物竞争进入市场,来解决药物的高成本,是FDA的首要任务。仿制药办公室(OGD)致力于提供有关仿制药计划信息和指导,作为FDA承诺的一部分,2019年仿制药办公室特别关注可以加快仿制药产品供应、并帮助美国患者降低价格的政策。
2019年的成就
FDA表示,2019年的成就包括,总共1,014个仿制药获得最终批准和初步批准。在这些批准中,有110个属于复杂的仿制药,这些仿制药很难开发,而且传统上在市场上缺乏竞争。批准的药物包括108种首仿药,包括用于治疗或预防严重疾病(例如肺动脉高压、乳腺癌、癫痫发作、中风、抑郁症和各种感染)的药物。
仿制药办公室还根据FDA的《药物竞争行动计划》(DCAP)和《仿制药使用者费用修正案》(GDUFA)计划,继续提高仿制药开发的效率。DCAP和GDUFA的一个关键部分是,通过应对可能出现的科学和法规挑战,使仿制药的批准更容易实现。
2019仿制药数字一览
批准或临时批准的ANDA申请:1,014 。
2019年批准了110种复杂仿制药,占仿制药产品批准总量的11%。
出版了269 项针对产品的指南(PSG),以及4项针对行业的新指南或修订指南,以及1项针对利益相关者的政策和程序手册(MAPP)。
发出了2,311份完整的答复函,详细说明了申请人在FDA批准之前需要解决的重要事项。
2019年收到了105 项ANDA会议要求,讨论产品开发和/或提交前问题。
10,000多名 外部利益相关者参加了六次会议和研讨班
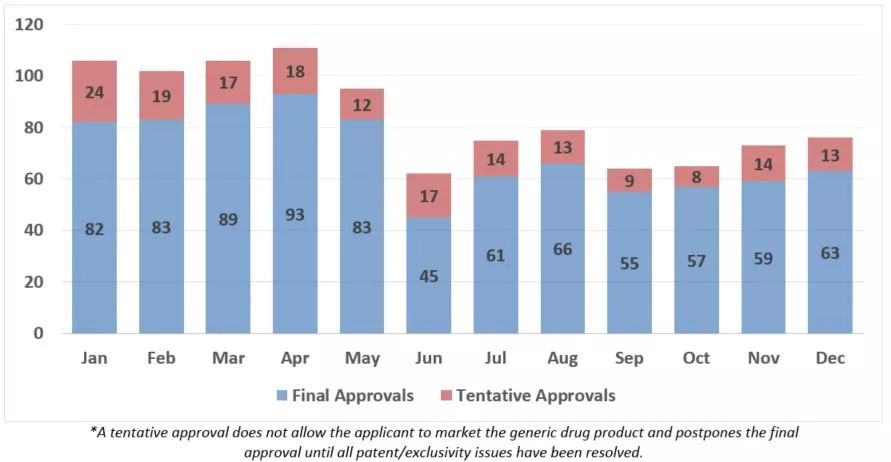
图:2019年逐月仿制药批准或临时批准情况
仿制药创新研究项目给予资助
在仿制药创新研究项目上,FDA资助了14项新研究合约,并为授予了3个奖项。这些合约和奖项与FDA当前的法规科学重点相一致,旨在帮助推进仿制药的开发及其安全有效的使用。
在这些研究项目之一中,获奖者将探索长效注射剂的模型和生物等效性评估策略的开发,以帮助确保长效注射剂的仿制版本与原研产品具有等同性。在另一个项目中,获奖者将基于文本分析和机器学习开发并实施一种新颖的数据工具。
2020年仿制药展望
在2020年,公共卫生将仍然是最重要的,同时FDA的仿制药办公室将继续推动与美国、世界各地的行业、研究团体、立法者、患者、医疗提供者以及其他利益相关者进行互动。
FDA即将发布的复杂仿制药产品特定产品指南,说明FDA在未来12个月内的指南发布计划。通过共享诸如此类的工具,并进一步提高FDA在评估仿制药应用方面的效率。
最后,FDA声明,将继续尽一切努力,确保美国人能够获得负担得起的高质量仿制药。
原文链接:
2019 Office of Generic Drugs Annual Report
https://www.fda.gov/drugs/generic-drugs/2019-office-generic-drugs-annual-report
Serving Public Health Paramount in a Successful 2019 for FDA’s Generic Drug Program
https://www.fda.gov/news-events/fda-voices-perspectives-fda-leadership-and-experts/serving-public-health-paramount-successful-2019-fdas-generic-drug-program
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..