日前,Horizon Therapeutics公司宣布,美国FDA皮肤和眼科药物咨询委员会(DODAC)全票支持该公司的全人源化单克隆抗体teprotumumab用于治疗甲状腺眼病(TED)。新闻稿指出,如果获得批准,teprotumumab将是唯一一款治疗TED患者的获批疗法,将满足重大未竟医疗需求。
TED是一种威胁视力的罕见进行性严重自身免疫性疾病。患者的症状包括眼球突出、复视、视力模糊、疼痛和面部畸形等,可能严重影响患者的生活质量。虽然TED经常发生在患有甲状腺机能亢进症或格雷夫斯病(Grave’s disease)的人身上,但是它是一种独特的疾病,是由于自身抗体激活了眼眶内细胞中胰岛素样生长因子1受体(IGF-1R)介导的信号复合体而引起的。在进入稳定期之前,TED会处在活跃期大约两到三年。活跃期TED缺乏有效的治疗手段。直至进入稳定期后,TED才可以接受眼眶、眼肌等眼科手术来恢复视力或外表。
Teprotumumab是胰岛素样生长因子1受体(IGF-1R)的完全人源化单克隆抗体。通过与IGF-1R结合,阻断IGF-1R介导的信号通路。它已经获得FDA授予的突破性疗法认定、孤儿药资格、快速通道资格、和优先审评资格。
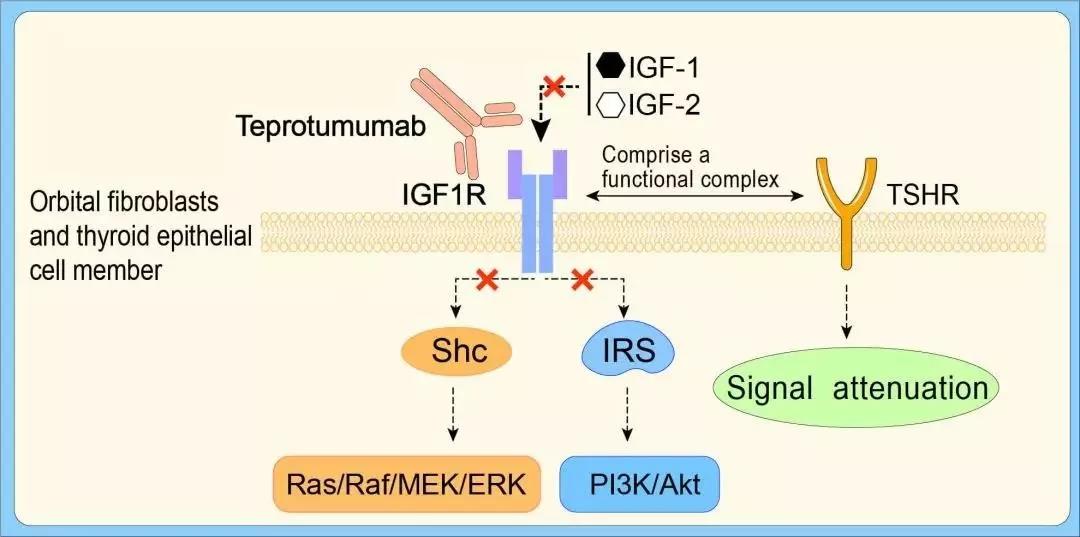
▲Teprotumumab的作用机制(图片来源:参考资料[2])
Teprotumumab治疗TED的有效性和安全性得到了大量临床证据的支持。BLA的提交是基于名为OPTIC的验证性3期临床试验的积极结果,以及一项2期临床试验的结果。OPTIC研究发现,接受治疗6个月内,接受teprotumumab治疗的患者中,82.9%的患者眼球突出有明显改善,安慰剂组这一数值为9.5%。同时,teprotumumab达到所有次要终点,包括减少复视,生活质量改善等。
“今天的全票支持标志着向FDA批准的第一个针对TED患者的疗法迈出的重要一步,这是一种威胁视力的自身免疫性疾病,”Horizon公司总裁兼首席执行官Timothy Walbert先生说:”我们相信teprotumumab有潜力解决这些患者未得到满足的重大需求,我们期待着与FDA合作完成对申请的审查。”
参考资料:
[1] FDA Advisory Committee Votes Unanimously to Support the Use of Teprotumumab for the Treatment of Thyroid Eye Disease (TED). Retrieved December 13, 2019, from https://www.businesswire.com/news/home/20191213005479/en
[2]. Teprotumumab Overview. Retrieved Feb. 28, 2019, from https://www.creativebiolabs.net/teprotumumab-overview.htm
原标题:速递 | FDA咨询委员会全票支持!罕见眼病首款疗法有望问世
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..