12 月 9 日,CDE 官网显示,普众发现的 1 类新药 AMT-253 拟被纳入突破性治疗品种,适应症为既往经一线治疗的不可手术的局部晚期、复发或转移性黑色素瘤。 Insight 数据库显示,该药是全球首个且目前唯一进入临床阶段的 MUC18 ADC,同时也是全球首个进入临床的 MUC18 靶向药。
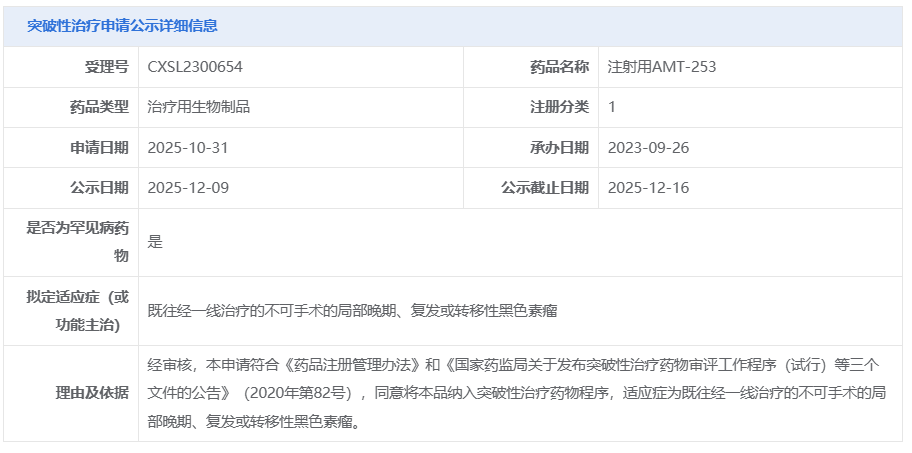
截图来源:CDE 官网
AMT-253 是普众发现开发的一款全球首创 MUC18 ADC。MUC18 是一种肿瘤抗原,在肿瘤生长和进展中发挥重要作用,并在包括黑色素瘤在内的多种实体瘤上广泛表达。
AMT-253 由与 MUC18 具有高结合亲和力的专有抗体、蛋白酶可切割的连接子,以及依喜替康有效载荷(一种有效的经临床验证的拓扑异构酶-1 抑制剂)组成,药物抗体比值约为 8。据普众发现介绍,AMT-253 的连接子专门设计用于连接依喜替康有效载荷,可生成高度稳定和均一的 ADC。该有效载荷不是 BCRP/P-gp 的底物,BCRP/P-gp 是导致许多疗法产生化疗耐药性的药物外排泵。
目前,普众发现正在 I/II 期临床试验 (NCT06209580) 中评估 AMT-253 在晚期恶性黑色素瘤及其他晚期实体瘤患者中的疗效和安全性。2025 年 10 月,普众发现在 ESMO 年会上公布了 AMT-253 用于晚期恶性黑色素瘤及其它实体瘤的初步积极数据。
这项临床 I/II 期首次人体试验在澳洲和中国开展。研究的主要目的是评估 AMT-253 在晚期实体瘤受试者中的最大耐受剂量/推荐 II 期剂量、安全性、耐受性、免疫原性及初步疗效。Ia 期将确定扩展阶段的推荐剂量,Ib/II 期将着重在选定肿瘤类型中进一步评估 AMT-253 的安全性和疗效。
截至 2025 年 9 月 8 日,已有 170 例受试者的数据可供安全性分析。这些受试者接受每三周一次(Q3W)的 AMT-253 治疗,剂量范围为 1.6 至 5.6 mg/kg。入组的受试者主要为恶性黑色素瘤、子宫内膜癌、宫颈鳞癌和子宫平滑肌肉瘤。入组的恶性黑色素瘤既往接受过 1-7 线的治疗,在未经 MUC18 表达筛选、且经多线治疗恶性黑色素瘤受试者中观察到积极的疗效信号。
I/II 期数据显示:
所有的恶性黑色素瘤受试者的客观缓解率(ORR)为 28.6%(16/56)。
在未经化疗治疗的恶性黑色素瘤中,皮肤型、肢端型和黏膜型的 ORR 分别为 35%(7/20)、50%(5/10)和 33.3%(1/3),初步的中位无进展生存期(mPFS)分别为 8.6、8.3 和 11.0 个月。
在潜在扩展剂量下的皮肤型黑色素瘤,ORR 达到 38.9%(7/18),mPFS 达到 8.6 个月。
在子宫内膜癌、宫颈鳞癌和子宫平滑肌肉瘤均看到初步疗效。在不同 MUC18 表达水平的患者中均观察到明确的抗肿瘤活性。
AMT-253 安全性和其他 TOP1 抑制剂类 ADC 一致,最常见的治疗相关不良事件为可控的血液学毒性。无间质性肺炎和神经毒性发生。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..