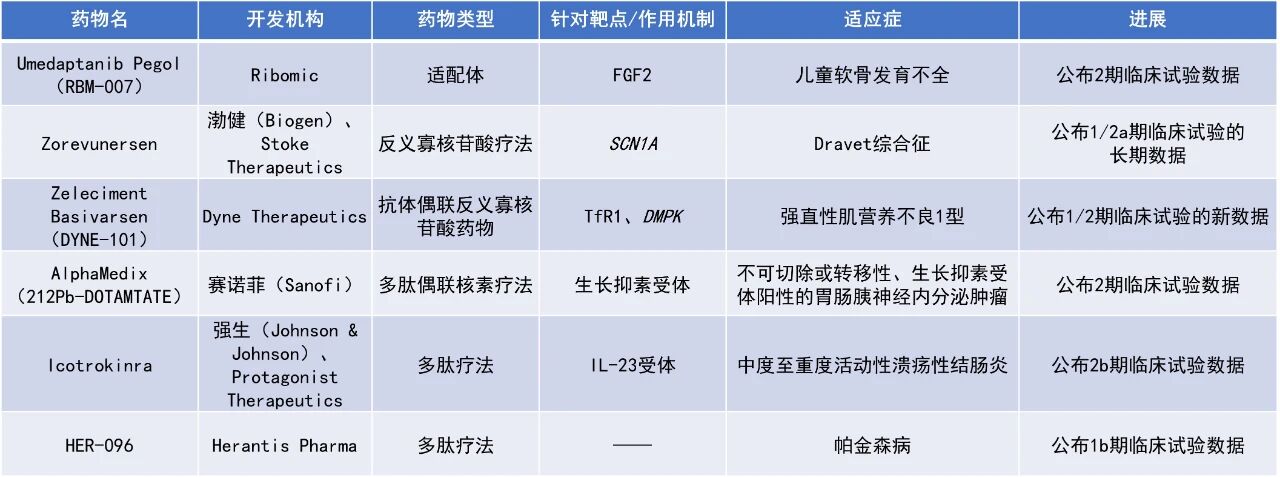
近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。渤健(Biogen)与Stoke Therapeutics公司共同公布了反义寡核苷酸(ASO)药物zorevunersen的最新研究进展,临床医生和护理人员报告了95%的Dravet综合征患者接受治疗3年时整体临床状况有改善。RIBOMIC公司公布了umedaptanib pegol治疗软骨发育不全症的2期研究的积极结果,显示每两周给药一次可使5岁及以上儿童的年化生长速率最高提升5.0 cm/年。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
Zorevunersen:公布1/2a期临床试验的长期数据
渤健(Biogen)与Stoke Therapeutics公司共同宣布了针对Dravet综合征的在研ASO药物zorevunersen的最新研究进展。该药物旨在通过增强SCN1A基因非突变(野生型)拷贝的功能,提升脑细胞中NaV1.1蛋白的表达,从而治疗Dravet综合征的根本病因。Zorevunersen已证明其对Dravet综合征的缓解潜力,获得了美国FDA授予的突破性疗法认定、罕见儿科疾病认定,以及FDA和欧洲药品管理局(EMA)授予的孤儿药资格。Stoke公司拥有该药在美国、加拿大和墨西哥的独家权益,渤健则拥有其余国家和地区的商业化权利。
此次公布的1/2a期和正在进行的开放标签扩展(OLE)研究数据表明,zorevunersen的耐受性良好。最新公布的两年分析数据显示,接受zorevunersen治疗的Dravet综合征患者在认知和行为方面持续改善,这与一项同样为期两年的自然病史研究中患者几乎无改善的结果形成鲜明对比。在为期三年的OLE研究中,临床医生和护理人员分别报告了95%(n=19)的患者整体临床状况得到改善。在1/2a期研究中,以70 mg初始剂量后接45 mg维持剂量的方案疗效最为显著,该方案目前正在3期EMPEROR研究中进行验证。
Umedaptanib Pegol(RBM-007):公布2期临床试验数据
RIBOMIC公司宣布,其针对5-14岁软骨发育不全症(ACH)儿童患者开展的umedaptanib pegol的2期临床试验取得了积极结果。该药物是一种新型寡核苷酸类适配体,具有强效抗成纤维细胞生长因子2(FGF2)活性,已获得日本厚生劳动省的孤儿药资格。
此次公布的结果显示,队列1(0.3 mg/kg,每周一次)的5名受试者中有3人的身高增长率较治疗前提高,其中两人分别增加4.6 cm/年和3.3 cm/年。队列2(0.6 mg/kg,每两周一次)的6名受试者全部完成试验,其中5人的身高增长率有提高,2人显著增加5.0 cm/年和2.0 cm/年,4名生长显著提升患者的身高增长率增幅超过了一款需每日注射的已获批药物的平均身高增长率增幅(+1.7 cm/年)。队列1和队列2的平均身高增长率分别为+1.5 cm/年和+1.4 cm/年,与前述已获批药物相当。整个试验期间未发现安全性问题。该结果证实umedaptanib pegol在改善ACH患儿生长方面具有显著疗效、良好安全性和持久作用,成功实现概念验证。该结果还表明提高单次剂量可延长给药间隔,有望每周或每两周一次给药即达到与已获批每日注射药物相当的疗效,为需长期治疗的患儿提供益处。
Icotrokinra:公布2b期临床试验数据
强生(Johnson & Johnson)公布了其2b期研究ANTHEM-UC的第12周额外结果。该研究评估了其靶向口服多肽icotrokinra用于治疗中度至重度活动性溃疡性结肠炎(UC)成人患者的疗效和安全性。Icotrokinra能够选择性阻断IL-23受体(IL-23R)。IL-23是银屑病和其他皮肤病、风湿病和IL-23介导肠胃病中炎症反应的基础。Icotrokinra能够以高亲和力与IL-23R结合,并对人类T细胞中的IL-23信号转导产生强效的选择性抑制作用。值得一提的是,icotrokinra曾在今年被知名产业媒体猎药人(Drug Hunter)评为2024年度十大明星分子之一。
此次公布的结果显示,所有icotrokinra剂量组均达到了临床缓解的主要终点。在第12周时,接受每日一次400 mg、200 mg和100 mg icotrokinra治疗的患者的临床缓解率分别为63.5%、58.1%和54.7%,而安慰剂组仅为27%。在400 mg组中,达到临床缓解、症状缓解和内镜改善的患者比例均显著高于安慰剂组;200 mg和100 mg组也在这些次要终点上表现出相对于安慰剂的有意义改善。所有icotrokinra剂量组在治疗第4周时即显示出高于安慰剂的症状缓解率。安全性方面,截至第12周,各icotrokinra剂量组与安慰剂组在不良事件和严重不良事件的发生率上相似,表明其具有良好的安全性。
HER-096:公布1b期临床试验数据
Herantis Pharma公司宣布,其多肽疗法HER-096在帕金森病患者中开展的1b期试验取得了积极的顶线结果,并达到了所有主要和次要终点。HER-096旨在模拟大脑多巴胺神经营养因子(CDNF,一种已知可促进神经元细胞存活和功能恢复的蛋白质)的活性,有望阻止帕金森病的进展、修复纹状体损伤并显著改善患者的症状和生活质量。
此次公布的结果显示,该药在200 mg和300 mg剂量下重复给药,安全性和耐受性良好,并展现出与前期研究预测相符的药代动力学特性,且被证实能够穿透血脑屏障。此外,数据表明300 mg剂量每周两次的给药方案适合推进至2期临床试验。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..