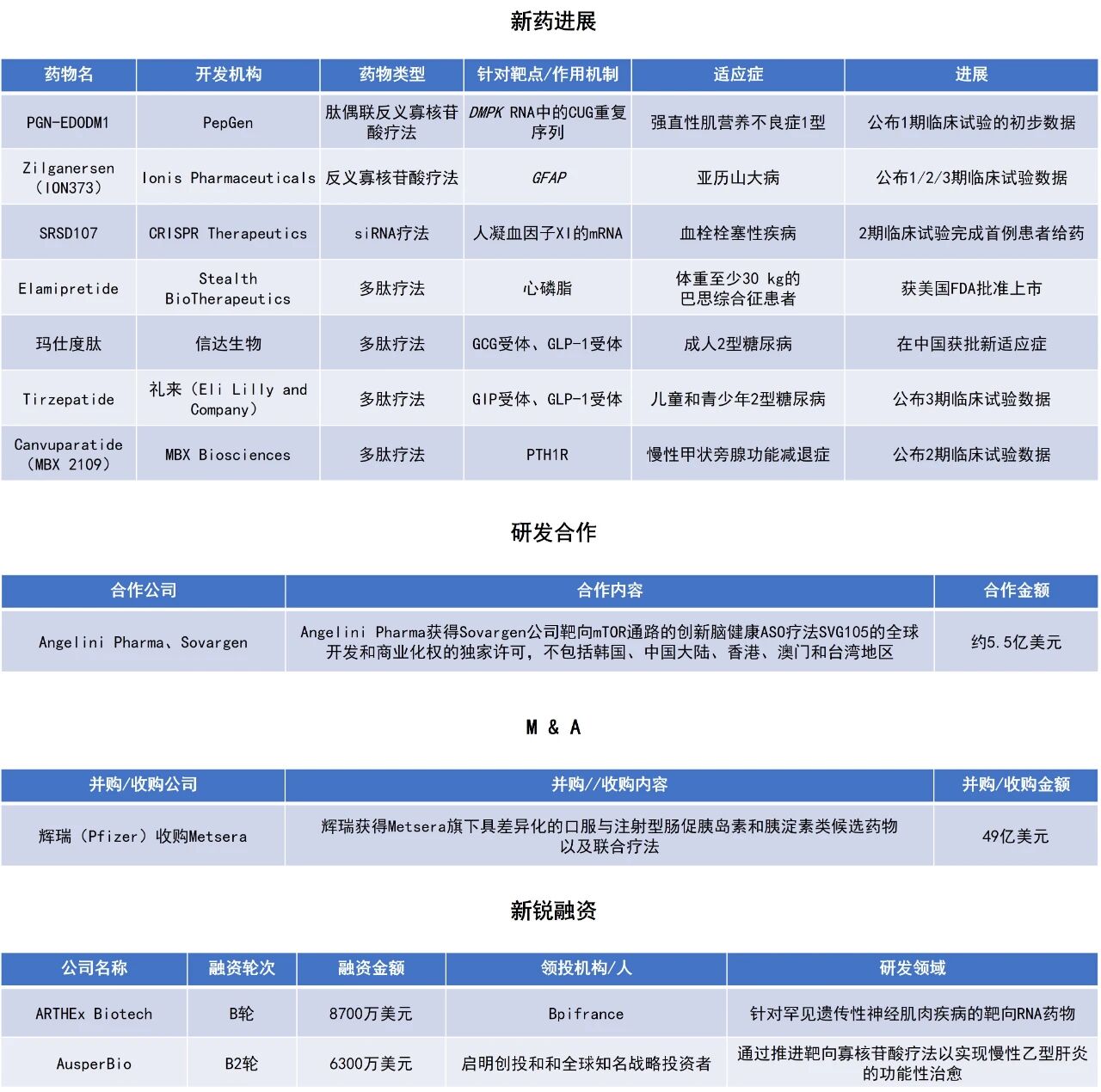
近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。美国FDA加速批准靶向线粒体的多肽疗法elamipretide上市,用于体重至少30 kg的巴思综合征(Barth syndrome)患者。根据FDA新闻稿,这是针对巴思综合征的首款获批疗法。辉瑞(Pfizer)与减肥疗法新锐Metsera公司宣布签署总额达49亿美元的最终收购协议。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
Elamipretide:获美国FDA批准上市
美国FDA加速批准Stealth BioTherapeutics所开发的Forzinity(elamipretide)上市,用于体重至少30 kg的巴思综合征患者。巴思综合征是一种超级罕见的X连锁遗传性线粒体疾病,患者体内参与线粒体心磷脂(cardiolipin)最终重塑步骤的酰基转移酶Tafazzin发生突变,进而引发患者心脏异常、运动不耐受、肌肉无力、严重疲劳和心力衰竭等症状。Elamipretide是一种水溶性多肽,不仅能穿透细胞屏障,还具有精准靶向线粒体的能力。该分子能高度选择性地结合线粒体内膜上独有的磷脂——心磷脂,能够稳定线粒体结构,提升ATP的产生,并有效减少有害活性氧(ROS)的生成。这一作用机制使其成为治疗巴思综合征的潜在理想药物。
此次美国FDA加速批准elamipretide,明确了其批准依据为患者用于使膝关节伸直的肌肉力量得到改善。FDA认为,这一改善很可能合理地预测患者获益,例如更容易站起或行走更远。根据FDA新闻稿,这是针对巴思综合征的首款获批疗法,标志着罕见病治疗领域又一项重要进展。
辉瑞收购减肥疗法新锐
辉瑞(Pfizer)与Metsera公司宣布签署总额达49亿美元的最终收购协议。此次收购将使辉瑞获得后者旗下具差异化的口服与注射型肠促胰岛素和胰淀素类候选药物以及联合疗法,这些项目在有效性与安全性方面具备“best-in-class”潜力。双方董事会均已一致通过该交易。
Metsera是一家临床阶段生物医药公司,致力于加速用于肥胖和心代谢疾病的下一代疗法。Metsera目前有4个项目处于临床开发阶段,并有多个项目在开展支持IND的临床前研究,目标是在减少注射次数的同时进一步提升疗效与耐受性。其中包括:每周或每月注射给药的GLP-1受体激动剂(RA)MET-097i(处于2期研究);每月给药的胰淀素类似物MET-233i(作为单药及与MET-097i联合的1期研究进行中);两款即将启动临床的口服GLP-1 RA;以及处于临床前阶段的营养刺激激素类药物。今年9月,MET-233i的1期初步结果公布,显示出“best-in-class”潜力。
Zilganersen(ION373):公布1/2/3期临床试验数据
Ionis Pharmaceuticals公司宣布,其在儿童与成人亚历山大病(Alexander disease,AxD)患者中开展的关键性研究取得积极的主要结果。AxD是一种罕见、进行性、最终致命的神经系统疾病。该病常在儿童期发病且进展迅速,患者可能丧失行走、说话与吞咽等基本功能。AxD的发生是神经胶质纤维酸性蛋白(GFAP)基因变异的结果,GFAP变异会破坏大脑中星形胶质细胞的结构和功能。Zilganersen旨在阻止由于GFAP基因中的致病变异而积累的过量GFAP蛋白,从而减缓或稳定AxD患者的疾病进展。
此次公布的结果显示,与对照组相比,接受反义寡核苷酸疗法zilganersen治疗的患者在第61周,在主要终点10米步行测试(10MWT)评估的步行速度上指标稳定(平均差异33.3%,p=0.0412),表现出统计学显著性且具临床意义。该疗法并展现出良好的安全性与耐受性;在多项关键次要终点上同样观察到一致性获益。根据新闻稿,zilganersen是在AxD患者中显示出改变疾病进程影响的首款在研疗法。Ionis计划于2026年第一季度提交新药申请(NDA)。Ionis神经科学高级副总裁Holly Kordasiewicz博士表示,这项“史无前例”的结果凸显了zilganersen为AxD患者带来新获批药物的可能。
Tirzepatide:公布3期临床试验数据
礼来(Eli Lilly and Company)公布了SURPASS-PEDS研究的详细结果,该研究是首个评估其糖尿病药物Mounjaro(tirzepatide,替尔泊肽)在10至18岁以下2型糖尿病儿童和青少年中安全性和有效性的3期临床试验。Mounjaro是一种GIP/GLP-1双受体激动剂,此前已获批用于成人2型糖尿病和肥胖症。
研究显示,在30周时,tirzepatide不仅达到了主要终点和所有关键次要终点,还表现出显著优于安慰剂的疗效:糖化血红蛋白(A1C)平均较基线(8.05%)降低2.2个百分点,同时身体质量指数(BMI)显著下降。在一项关键次要终点中,86.1%接受10 mg剂量的受试者达到了A1C≤6.5%的目标,BMI平均降低11.2%(30周时)。在为期52周的延伸研究中,血糖控制的改善和BMI的降低效果得以持续。该研究的安全性与既往成人研究结果基本一致。
PGN-EDODM1:公布1期临床试验的初步数据
PepGen公司公布了其在研药物PGN-EDODM1在治疗强直性肌营养不良1型(DM1)的1期临床试验FREEDOM-DM1中的积极数据。PGN-EDODM1利用公司专有的增强递送寡核苷酸(EDO)技术,递送一种旨在恢复RNA剪接蛋白MBNL1的正常剪接功能的寡核苷酸。该疗法通过结合DMPK转录本中的致病性CUG重复序列,干扰其与MBNL1的结合,从而恢复MBNL1的功能性下游剪接,并恢复患者的肌肉功能。该药物已获得美国FDA授予的孤儿药资格和快速通道资格,用于治疗DM1患者。
此次公布的结果显示,在15 mg/kg剂量组中,单次给药后的平均剪接校正率达53.7%,显著高于此前在DM1患者中报告的任何数据,且所有患者均表现出剪接功能的改善。该剂量下的药物总体耐受性良好,药物相关不良事件均为轻度或中度。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..