9 月 24 日,药物临床试验登记与信息公示平台官网显示,华东医药旗下中美华东登记了一项国内 Ⅲ 期临床,以评估 HDM1005 注射液在超重或肥胖成人受试者中的有效性和安全性。Insight 数据库显示,这是 HDM1005 启动的首个Ⅲ期临床。
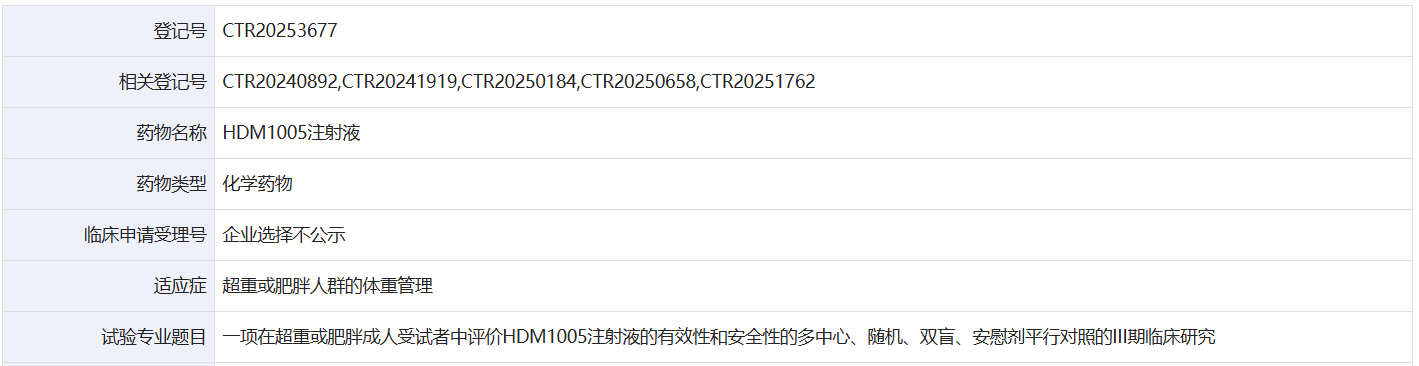
截图来源:药物临床试验登记与信息公示平台
HDM1005 是由中美华东研发的 1 类化学新药,是多肽类人 GLP-1 受体和 GIP 受体的双靶点长效激动剂。临床前研究显示,HDM1005 可通过激活 GLP-1 受体和 GIP 受体,促进环磷酸腺苷(cAMP)产生,增加胰岛素分泌,抑制食欲,延迟胃排空,改善代谢功能,进而改善血浆容量、减少氧化应激和全身炎症、改善心血管适应性。
在国内,HDM1005 正在开展针对 2 型糖尿病、肥胖的临床研究,本次登记的是该药的首个 Ⅲ 期临床。这是一项多中心、随机、双盲、安慰剂平行对照的 III 期临床研究(CTR20253677),旨在评估与安慰剂相比,HDM1005 对超重或者肥胖受试者体重的疗效和安全性。研究将在国内 63 家医疗机构进行,计划入组 825 人。
2025 年 1 月,华东医药曾公布了 HDM1005 的中国 I 期临床试验结果。研究结果显示:
在 Ia 期和 Ib 期中 HDM1005 最常见的不良反应为食欲下降和胃肠道不良反应,一般呈剂量依赖性,严重程度均为轻度或中度。无 3 级低血糖发生,无严重不良事件发生,无受试者因不良事件 (AE)提前退出。
与安慰剂相比,单次和多次给药后可观察到口服葡萄糖耐量试验(OGTT)中 0~2 h 葡萄糖药物血药浓度下的曲线下面积 (AUC) 显著降低,且呈剂量依赖性。
在 Ia 期中,体重下降呈剂量依赖性,在 D8 时 5 mg 组体重最大平均下降为 3.92 kg(5.36%)。
在 Ib 期中,经过 4 周治疗,0.5-4.0 mg 组在 D29 时的体重平均下降幅度为 4.79-7.76 kg(6.12%-10.29%),并且在停止治疗后 4 周体重下降仍可维持。在 HDM1005 组中,到第 4 周时体重下降>5% 的受试者比例为 87.5%,而安慰剂组为 25%。此外,HDM1005 还可降低第 4 周时的总胆固醇、甘油三酯和低密度脂蛋白胆固醇水平。
Insight 数据库显示,在 GLP-1R/GIPR 双靶点新药赛道,全球现仅有礼来的替尔泊肽获批上市。今年 9 月 1 日,恒瑞医药的 HRS9531 已申报上市,用于肥胖或超重成人患者的长期体重管理。此外,还有多款同靶点新药在国内进入了Ⅲ期,分别来自翰森制药、博瑞生物、安进、众生药业、华东医药。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..