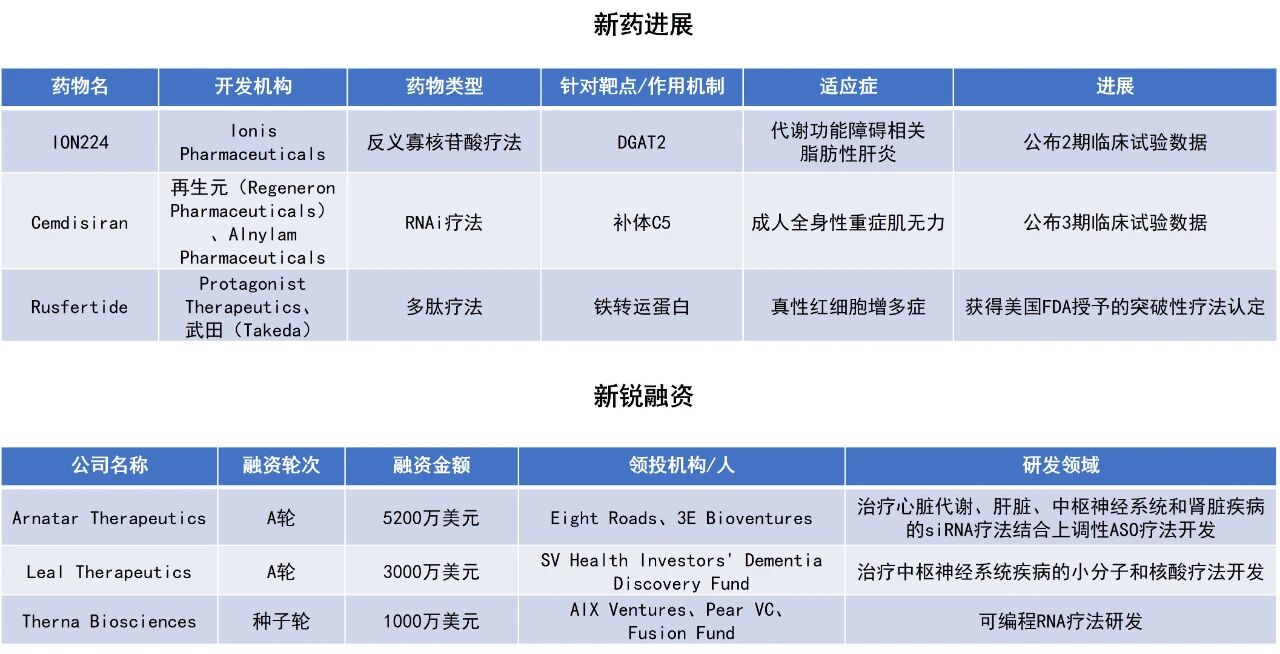
近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。Ionis Pharmaceuticals公司用于治疗代谢功能障碍相关脂肪性肝炎(MASH)的反义寡核苷酸(ASO)疗法ION224获积极2期临床试验结果,可使近六成患者获得肝脏组织学改善且纤维化未恶化。Protagonist Therapeutics与武田(Takeda)共同开发的在研多肽疗法rusfertide获美国FDA授予突破性疗法认定,用于治疗真性红细胞增多症(PV)患者。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
ION224:公布2期临床试验数据
《柳叶刀》(The Lancet)上发表了一项创新ASO药物ION224用于治疗MASH患者的2期临床试验的积极结果。ION224是一种靶向二酰基甘油O-酰基转移酶2(DGAT2)的ASO,作用于肝脏。MASH的特征是肝脏脂肪过度堆积,并随之引发肝脏炎症、肝细胞损伤和死亡,最终导致纤维化。由于MASH中甘油三酯的合成主要由DGAT2的催化活性驱动,因此抑制DGAT2的活性可能延缓代谢功能障碍相关脂肪性肝病(MASLD)的进展。ION224通过与编码DGAT2的mRNA结合,抑制其表达。
研究的主要终点为非酒精性脂肪肝疾病活动性评分降低≥2分,且气球样变或小叶炎症改善≥1分,且51周时纤维化未恶化。在遵从治疗方案的患者中,ION224 90 mg组和120 mg组分别有46%和59%的患者达到主要终点,而安慰剂组仅为19%。值得注意的是,ION224还显著降低了肝脏脂肪含量,且具有剂量依赖性和时间依赖性。这些改善不依赖于体重变化(研究期间参与者的体重基本不变),提示ION224具有独立于代谢减重的直接抗脂肪生成机制,且具有与其他疗法(如GLP-1疗法)联合应用的潜力。
Rusfertide:获得美国FDA授予的突破性疗法认定
Protagonist Therapeutics宣布,其与武田共同开发的在研药物rusfertide获美国FDA授予突破性疗法认定,用于治疗真性红细胞增多症患者。Rusfertide是一种潜在“first-in-class”的在研天然激素铁调素的多肽模拟物,已获美国FDA的孤儿药资格和快速通道资格。公司预计将在今年第四季度提交新药申请(NDA)。
此次突破性疗法认定主要基于3期VERIFY研究的积极数据。今年6月所公布的数据显示,该研究达到主要终点,rusfertide联合当前标准治疗在高危和低危PV患者中使临床缓解率较安慰剂联合当前标准治疗组患者翻倍(76.9%对比32.9%),显著降低需放血治疗的患者比例。所有关键次要终点也均达到统计学显著差异,包括rusfertide联合治疗组需放血治疗的患者比例显著下降(27%对比78%),保持血细胞比容水平低于45%的患者比例显著提升(62.6%对比14.4%),患者报告的结局也有所改善。此外,未报告任何与rusfertide相关的严重不良事件。
Cemdisiran:公布3期临床试验数据
再生元(Regeneron Pharmaceuticals)宣布,其与Alnylam Pharmaceuticals联合开发的补体C5靶向RNAi疗法cemdisiran,在用以治疗成人全身性重症肌无力(gMG)的NIMBLE临床3期试验中达到了主要和关键次要终点。再生元计划在与FDA沟通后,于2026年第一季度提交cemdisiran单药的监管申请。
分析显示,每三个月皮下注射一次的cemdisiran单药显示出平均74%的补体活性抑制率。而cemdisiran与C5抗体pozelimab的联合疗法则达成接近99%的补体活性抑制。此外,cemdisiran单药在日常生活活动量表(MG-ADL)总分(主要终点)方面,实现了相较安慰剂2.30分的改善(p=0.0005)。而联合疗法在MG-ADL总分上,则实现了相较安慰剂1.74分的改善(p=0.0086)。
RNA疗法新锐正式亮相,A轮融资获5200万美元
Arnatar Therapeutics公司宣布结束隐匿模式正式公开亮相。Arnatar Therapeutics是一家临床阶段的生物技术公司,旨在重新定义RNA药物的潜力。公司凭借其专有的DARGER平台,创新性地整合了潜在“best-in-class”的siRNA基因沉默技术与潜在“first-in-class”的可上调蛋白表达的ASO技术。其具备双重作用的RNA疗法可通过siRNA沉默有害的疾病驱动因素,并通过上调ASO恢复基本蛋白质功能,为以前无法治愈的疾病开辟新的治疗可能性。该公司管线覆盖心脏代谢、肝、肾及中枢神经系统疾病等具有高未竟需求的领域。此外,该公司于2024年完成了5200万美元的A轮融资,由Eight Roads和3E Bioventures领投。
新闻稿同时宣布,其治疗Alagille综合征(ALGS)的在研ASO药物ART4已获得美国FDA授予的孤儿药资格和罕见儿科疾病认定。ART4是Arnatar公司针对ALGS病因开发的上调性ASO疗法,基于其专有的ACT-UP1平台设计,旨在通过上调内源性JAG1蛋白的表达,从根源上解决ALGS的病因。该药物采用皮下注射给药,设计为每月给药一次。在经过验证的ALGS小鼠疾病模型中,临床前研究显示,ART4显著提升了JAG1蛋白水平,恢复了胆管发育,并降低了肝损伤标志物(包括胆汁酸和ALT)水平。该疗法在成年和新生动物中均表现出良好的耐受性。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..