近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。在研环肽疗法certepetide联合标准化疗和免疫检查点抑制剂一线治疗局部晚期不可切除胰腺导管腺癌,总缓解率(ORR)达60%,总体疾病控制率(DCR)为100%。Ascendis Pharma公司公布了其治疗甲状旁腺功能减退症的多肽疗法palopegteriparatide的积极长期数据,96%的患者在持续治疗3.5年后仍无需依赖常规治疗。恒瑞医药自主研发的胰高血糖素样肽‑1(GLP-1)和葡萄糖依赖性促胰岛素肽(GIP)双重受体激动剂HRS9531注射液达3期临床试验终点,计划近期在中国递交用于长期体重管理的新药上市申请(NDA)。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
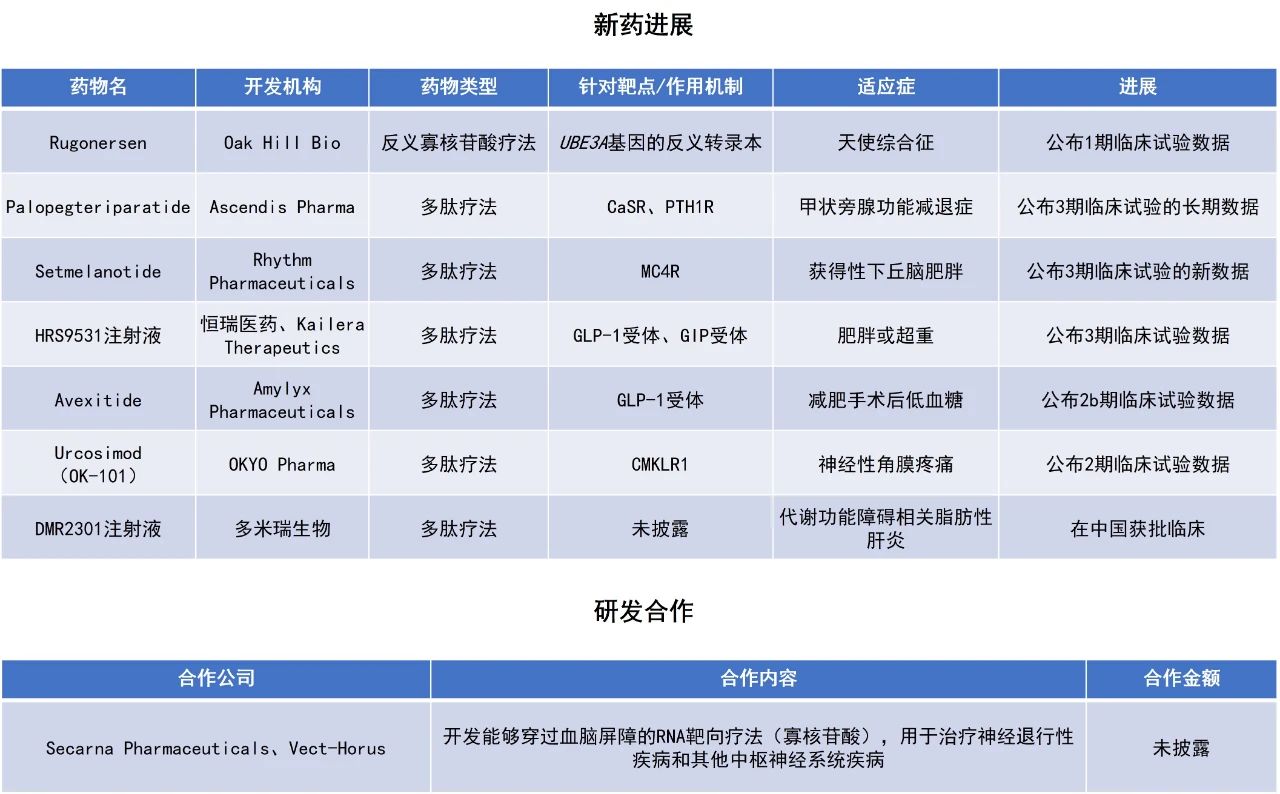
Certepetide(LSTA1):公布1b/2a期临床试验的初步数据
Lisata Therapeutics公司公布了其1b/2a期临床试验iLSTA的初步结果。该试验评估了Lisata公司的在研环肽疗法certepetide联合标准治疗化疗和免疫检查点抑制剂,作为一线疗法治疗局部晚期不可切除胰腺导管腺癌患者的效果。Certepetide旨在激活一种肿瘤特异性的转运系统,使与之联合使用的全身性抗癌药物能够更有效地穿透肿瘤并在肿瘤内蓄积。此外,certepetide还被证明可以调节肿瘤微环境,使肿瘤对免疫疗法更加敏感。
初步数据显示,该联合疗法的ORR为60%,总DCR为100%。经过4个治疗周期后,20名患者中有13名获得了部分缓解(PR),1名获得了完全缓解(CR),其余6名患者达到疾病稳定(SD,肿瘤大小减少<22.0%)。没有患者的肿瘤大小增加。此外,16名患者的肿瘤标志物CA19-9水平下降,其中7名患者的CA19-9水平下降>90%,9名患者的CA19-9水平下降>50%。
Palopegteriparatide:公布3期临床试验的长期数据
Ascendis Pharma公司公布了palopegteriparatide治疗甲状旁腺功能减退症成人患者的3期临床试验PaTHway的最新长期数据。该研究包括26周的随机、双盲、安慰剂对照期,随后进入开放标签扩展期,持续至第182周。Palopegteriparatide是一种甲状旁腺激素(PTH)前药,它旨在每天将PTH恢复至生理水平24小时,以解决甲状旁腺功能减退的短期症状和长期并发症。
该试验的总体留存率很高,最初入组的82名成年人中有73人(89%)完成了为期3.5年的试验。数据显示,在接受palopegteriparatide长期治疗至第156周时,64名(88%)患者继续保持正常的白蛋白校正血清钙水平,70名(96%)患者无需依赖常规治疗(定义为每日钙摄入量≤600 mg且不使用活性维生素D)。此外,估算肾小球滤过率(eGFR)与基线时相比有改善,并持续至156周。患者报告其甲状旁腺功能减退相关症状和健康相关生活质量较基线有持续改善,第156周的24小时尿钙排泄也保持正常。安全性方面,该疗法总体耐受良好,未出现新的安全信号,大多数治疗伴发不良事件(TEAE)为轻度或中度,没有与研究药物相关的严重TEAE或停药。
HRS9531注射液:公布3期临床试验的新数据
恒瑞医药与Kailera Therapeutics公司共同宣布,HRS9531注射液治疗中国肥胖或超重受试者的3期临床试验获得积极顶线结果。HRS9531是恒瑞医药自主研发的GLP-1和GIP双重受体激动剂,拟开发用于超重/肥胖及相关合并症、以及2型糖尿病等适应症的治疗。2024年5月,Kailera Therapeutics获得了HRS9531除大中华区以外的全球范围内开发、生产和商业化的独家权利。恒瑞医药计划近期在中国递交HRS9531注射液用于长期体重管理的NDA,Kailera Therapeutics正在推进该疗法的全球临床研发。
此次公布的结果显示,与安慰剂相比,HRS9531所有剂量组(2 mg、4 mg、6 mg)在共同主要终点及全部关键次要终点上均达到优效性。主要分析结果表明,HRS9531注射液治疗48周后,平均体重降低最高达17.7%(安慰剂调整后为16.3%),体重降低≥5%的受试者比例达88.0%。此外,高剂量组44.4%的受试者体重降低≥20%。补充分析结果显示,HRS9531治疗组平均体重降低最高达19.2%(安慰剂调整后为17.7%)。HRS9531显示出良好的安全性和耐受性,与其他GLP-1药物治疗和HRS9531先前报道的2期临床数据一致。
Rugonersen:公布1期临床试验数据
Oak Hill Bio公司宣布,其治疗天使综合征的在研药物rugonersen的1期临床研究结果已在学术期刊Nature Medicine上发表。Rugonersen是一种靶向UBE3A-ATS的反义寡核苷酸(ASO)药物,旨在治疗由UBE3A蛋白缺失引起的罕见遗传性神经发育疾病天使综合征。正常情况下,神经元中只有母源UBE3A基因表达,父源基因则被长链非编码RNA UBE3A-ATS沉默。Rugonersen通过抑制UBE3A-ATS,可使原本沉默的父源UBE3A基因重新表达,从而恢复UBE3A蛋白的生成,有望从病因层面治疗该病。该公司于今年4月与罗氏(Roche)达成独家许可协议,获得了rugonersen的独家开发和商业化权利,并计划于2026年初启动关键性的3期临床试验。
在该研究中,rugonersen显示出与同类反义寡核苷酸一致的安全性和耐受性。研究结果还表明,与自然病史相比,使用rugonersen治疗导致脑功能药效生物标志物、脑电图(EEG)δ功率的病理脑活动剂量依赖性地部分正常化,并改善了测量天使综合征核心症状的多个探索性终点。这些结果为进一步测试rugonersen在天使综合征中的效果提供了有力支持。
Avexitide:公布2b期临床试验数据
Amylyx Pharmaceuticals公司公布了avexitide用于治疗减肥手术后低血糖(PBH)的2b期临床试验的新探索性分析结果。Avexitide是一种潜在“first-in-class”的GLP-1受体拮抗剂,旨在结合胰岛β细胞上的GLP-1受体,并阻断GLP-1的作用,通过减少胰岛素分泌和稳定血糖水平来缓解低血糖。在PBH患者中,过多的GLP-1会导致胰岛素分泌过多,随后出现严重的低血糖事件。
在2b期试验中,每日一次90 mg的avexitide使PBH患者的2级和3级低血糖事件的综合最小二乘平均值降低64%。群体药代动力学和药效学数据显示,在该给药剂量下,avexitide在24小时内具有持续的治疗暴露水平。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..