基于Pink Sheet数据库,2025年上半年,EMA的优先药物计划(PRIME)共收到23项申请,其中仅8项获得批准,其余15项未能满足EMA严格的资格标准。一如既往,多数申请未能通过。
认定过程相当严格,三分之二被拒
PRIME计划于2016年3月启动,旨在支持和加快未满足医疗需求药物的开发。迄今为止,共有151种药物获得了PRIME认定,有395种被拒绝。每年接受的产品数量在13至20之间。共有21种药物在开发阶段被申办方撤回,通常是因为开发终止。40个药物已获得欧盟上市许可,不过其中一种——Tavneos(avacopan)——在申报上市前退出了计划。
尽管PRIME筛选过程严格,但其在开发者中仍具有吸引力。EMA最近报告称,2024年收到的PRIME认定申请比2023年增加了12%。然而,2024年有14个药物获得认定,少于2023的18个。
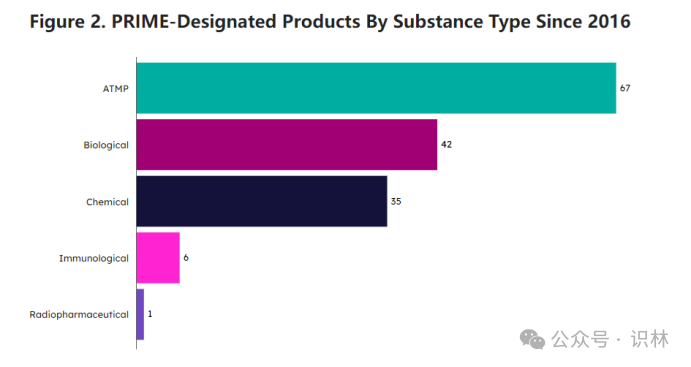
从品种类型看(上图),大多数是先进治疗药品(ATMP,EU定义涵盖基因治疗、体细胞治疗和组织工程产品),生物制品略多于化药。从治疗领域来看,2025年上半年认定的药物针对传染病、神经学、先天性、家族性和遗传性疾病、泌尿肾病学以及免疫-风湿-移植。迄今为止,PRIME认定大多授予了肿瘤药物,根据最新清单,该领域共有39个药物,其次是内分泌-妇科-生育-代谢(19)和血液-凝血(18)。
获得PRIME认定并非必然加快审评
尽管部分获得PRIME认定的品种也进入加快审评通道,但许多未能真正提前上市。
2025年上半年获得批准的产品中,只有Vimkunya通过加快审评在大约六个月内完成了审评。Krystal的Vyjuvek加快审评申请于2022年11月被EMA接受,但该公司随后决定转而采用标准时间表,最终大约花费15个月。即将获批的药物中,Autolus的Aucatzyl加快审评请求被拒绝,而Zemcelpro曾获得加快审评,但随后恢复为标准时间表。
正在进行审评的PRIME认定产品的上市许可申请中,只有Insmed的brensocatib(用于治疗非囊性纤维化支气管扩张)处于加快审评通道。apitegromab、mozafancogene autotemcel和UCB的deoxythymidine/doxecitine的加快请求被拒绝。Sanofi似乎并未为teplizumab申请加快审评。
自2022年以来,获得上市许可的20个PRIME认定产品中,只有6个是加快审评获批的(不包括Tavneos)。而2024年上市的6个PRIME药物中只有1个加快获批。
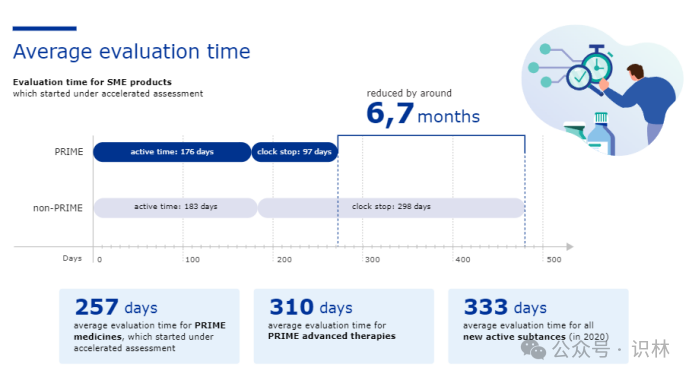
从2022年3月EMA发布的PRIME 5年总结中也可以看出,只有加快审评的药物可以得到平均约70天的提前(257天 vs 333天),否则PRIME与其他新药审评时限并无显著差异(310天 vs 333天)。
EMA的加快审评资格条件是对公共卫生和治疗创新具有重大意义。在集中审批程序下,加快审评可将原定210天的审评时限缩短至150天(不包括暂停计时)。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..