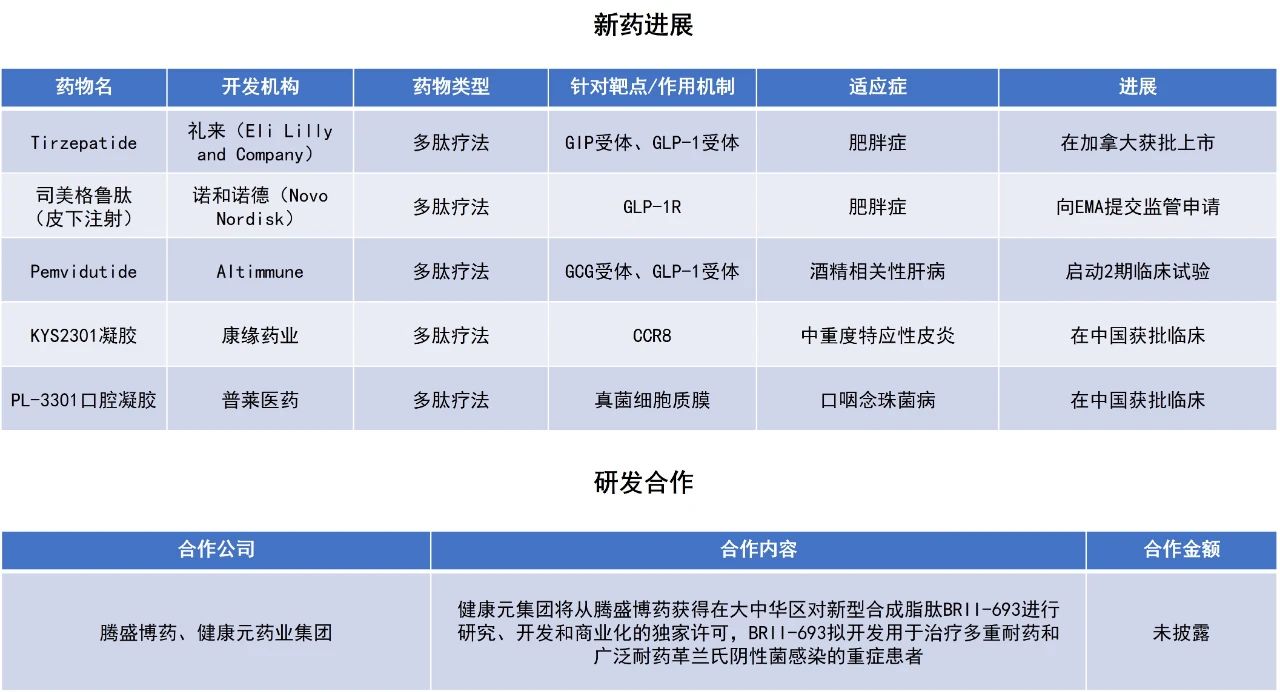
Tirzepatide:在加拿大获批上市
礼来宣布,加拿大卫生部已批准葡萄糖依赖性促胰岛素多肽(GIP)/胰高血糖素样肽-1(GLP-1)受体激动剂tirzepatide(商品名:Zepbound KwikPen)用于慢性体重管理,每周注射一次,作为饮食和运动的辅助疗法。该药适用于肥胖(BMI≥30 kg/m²)或超重(BMI在27 kg/m²至30 kg/m²之间)的成年人,并且至少有一种与体重相关的疾病,如高血压、血脂异常、2型糖尿病、阻塞性睡眠呼吸暂停或心血管疾病。新闻稿指出,tirzepatide是首个获得加拿大卫生部批准用于慢性体重管理(包括减重和维持体重)的双重受体激动剂。
此次tirzepatide的获批主要基于4项3期临床试验(SURMOUNT-1~4)的结果。其中,在SURMOUNT-1研究中,相较于安慰剂组,2539名患有肥胖或超重及其相关疾病的非糖尿病患者接受tirzepatide注射联合饮食和运动治疗后,在72周时体重显著减轻。最高剂量组平均减重21.8公斤,最低剂量组平均减重15.4公斤,而安慰剂组仅减重3.2公斤。
司美格鲁肽:向EMA提交监管申请
诺和诺德宣布,已向EMA提交其重磅疗法Wegovy 7.2毫克新剂量的监管申请。此次申请旨在拓展Wegovy的治疗剂量选项,为肥胖患者(包括合并2型糖尿病者)提供更高剂量的治疗方案,进一步提升体重管理效果。
该申请主要基于两项临床研究数据:STEP UP试验和STEP UP T2D试验。前者评估了7.2毫克剂量Wegovy在单纯肥胖成人中的疗效与安全性,结果显示受试者平均体重减轻达21%,其中约三分之一患者体重下降幅度超过25%,显著优于安慰剂对照组。后者则在合并2型糖尿病的肥胖成人群体中验证了该剂量的疗效与耐受性。整体数据显示,该剂量的安全性良好,与此前获批的2.4毫克剂量及其他司美格鲁肽临床研究结果一致。
KYS2301凝胶:在中国获批临床
康缘药业宣布,其基于AI技术开发的创新趋化因子受体8(CCR8)多肽抑制剂KYS2301凝胶已成功在中国完成IND申报,适应症定位于特应性皮炎。
临床前研究显示,KYS2301对CCR8靶点具有高亲和力,局部皮肤涂抹KYS2301凝胶对治疗特应性皮炎具有良好的药效作用,毒理学和药代动力学研究证明KYS2301凝胶安全性高,系统暴露量低,且反复涂抹耐受性良好。
腾盛博药与健康元集团达成抗菌合成脂肽许可协议
腾盛博药宣布与健康元集团签署协议。健康元集团将从腾盛博药获得在大中华区对BRII-693进行研究、开发和商业化的独家许可。BRII-693是一种在研新型合成脂肽,拟开发用于治疗多重耐药和广泛耐药(MDR/XDR)革兰氏阴性菌感染的重症患者,尤其是耐碳青霉烯类鲍曼不动杆菌(CRAB)、铜绿假单胞菌(CRPA)以及肠杆菌(CRE)引起的感染。BRII-693是通过对多粘菌素支架进行迭代结构改造研发而成,旨在增强抗菌效力,同时降低老式多粘菌素制剂常见的毒性作用,如肾毒性和神经毒性。
在1期研究中,BRII-693在健康参与者中均表现出良好的安全性、耐受性和药代动力学特征。腾盛博药已从中国国家药品监督管理局药品审评中心(CDE)取得临床试验许可,获准在中国开展BRII-693的1期药代动力学(PK)桥接研究,以支持未来在医院获得性细菌性肺炎/呼吸机相关细菌性肺炎患者中开展3期注册试验。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..