7 月 2 日,NMPA 官网显示,金赛药业申报的 1 类新药注射用伏欣奇拜单抗(IL-1β 单抗冻干制剂,曾用名:注射用金纳单抗)获批上市,适用于对非甾体类抗炎药和/或秋水仙碱禁忌、不耐受或缺乏疗效的,以及不适合反复使用类固醇激素的成人痛风性关节炎急性发作。
伏欣奇拜单抗是金赛药业自主研发的一款抗白介素 1β(IL-1β)单抗,通过阻断 IL-1β 与 IL-1 受体 I(IL-1RI)和 IL-1 受体 II(IL-1RII)结合起到调节炎症的作用。
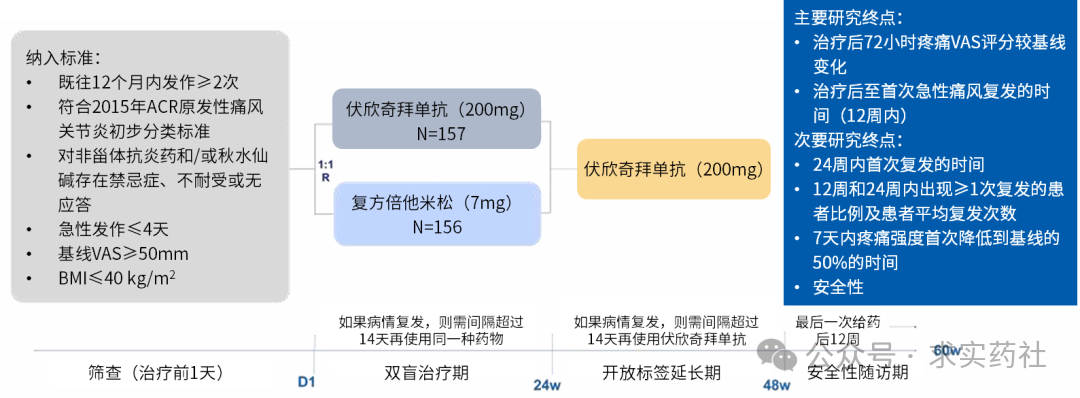
在 2025 年欧洲抗风湿病联盟(EULAR)年会上,伏欣奇拜单抗的 III 期研究 GUARD-1 的数据被公布。
这是一项在国内开展的多中心、随机、双盲、双模拟、阳性对照的 III 期研究。研究包括 24 周的双盲治疗及 24 周的开放治疗期。研究主要疗效终点包括:①治疗后 72 小时疼痛 VAS 评分较基线变化(非劣效性检验);②治疗后至首次急性痛风复发的时间(12 周内)(优效性检验)。
结果显示,在缓解疼痛方面,伏欣奇拜单抗组 72 小时疼痛 VAS 评分为 16.18±16.67 mm,复方倍他米松组为 19.19±21.35 mm。伏欣奇拜单抗 72 小时疼痛 VAS 评分较基线下降幅度非劣于复方倍他米松(-57.09mm vs. -53.77mm),治疗差异为 -3.32mm。两治疗组 VAS 疼痛评分下降 50% 的中位时间相似(24.5h vs. 24.3h )。在减少复发方面,伏欣奇拜单抗显著延缓了 12 周内痛风中位复发时间(未达到 vs. 45 天)。伏欣奇拜单抗 12 周内降低了 90% 复发风险,24 周内降低了 87% 复发风险。相较于复方倍他米松,伏欣奇拜单抗组复发率更低(12 周为 10.9% vs. 65.2%;24 周为 14.7% vs. 66.5%),且人均复发次数也更低(12 周为 0.2±0.52 vs. 1.2±1.27;24 周为 0.2±0.79 vs. 1.6±1.79)。
在安全性方面,伏欣奇拜单抗组的总不良事件和治疗相关不良事件例次分别为 365 和 146,而复方倍他米松组分别为 471 和 188。3 例治疗相关严重不良事件均出现在复方倍他米松组。
痛风性关节炎是一种患病率逐年升高的致残性疾病,目前部分患者对现有痛风常见治疗手段(如秋水仙碱、非甾体抗炎药(NSAIDs)等)存在药物禁忌、耐受性差或治疗后效果不佳,导致疾病进展。IL-1 抑制剂被国内外指南共同推荐用于上述患者的治疗,但此前国内尚无此类药物获批痛风治疗相关适应症。
Insight 数据库显示,全球范围内共 10 款 IL-1β 单抗在研(仅统计活跃状态),仅诺华卡那奴单抗(未在中国获批上市)和金赛药业伏欣奇拜单抗获批上市,三生国健 SSGJ-613 处于报上市阶段。伏欣奇拜单抗今日获批,成为国内首个获批上市的 IL-1β 单抗。
值得一提的是,为方便临床使用,免去注射前需要复溶与配置的步骤,在注射用伏欣奇拜单抗的基础上,金赛药业研制了伏欣奇拜单抗注射液这一新剂型,提高伏欣奇拜单抗的使用便捷性。
已完成的一项伏欣奇拜单抗在中国健康成年男性受试者中的随机、双盲、单次给药的生物等效性临床试验结果显示,伏欣奇拜单抗注射液和注射用伏欣奇拜单抗具有生物等效性且安全性良好。根据 Insight 数据库,该新剂型上市申请已于 2025 年 1 月获得 CDE 受理。