当地时间 5 月 9 日,ClinicalTrials.gov 官网显示,礼来登记了一项在中国和日本受试者中评估 LY4268989 (MORF-057) 药代动力学、安全性、耐受性、食物效应和药物相互作用的 I 期临床研究。
这是一项随机、平行分配的 I 期临床研究,计划纳入 66 名受试者。研究开始日期为 2025 年 5 月,完成日期 为 2025 年 7 月。
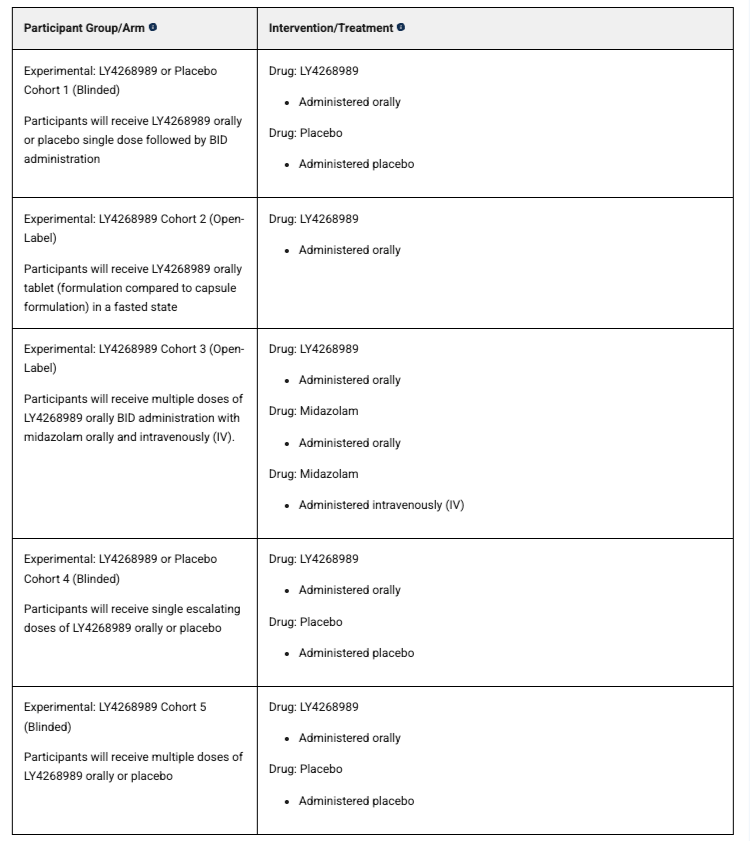
研究的主要终点是第 1 天至第 17 天,队列 1 和队列 5 的最大浓度(Cmax)、血药浓度-时间曲线下面积(AUC),队列 1、3、5 在治疗期间出现的不良事件和严重不良事件;第 1 天至第 13 天,队列 2 的 Cmax、AUC 等。
LY4268989 是 Morphic Therapeutic 开发的一款选择性口服 α4β7 整合素小分子抑制剂,用于治疗溃疡性结肠炎、克罗恩病、炎症性肠病等。2024 年 8 月,礼来以 32 亿美金的价格收购 Morphic 囊获了该产品。如今,该产品正在开展溃疡性结肠炎和克罗恩病的 II 期临床。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..