根据 Insight 数据库,今年 3 月份(3.1- 3.28),共计有 14 款新药在国内递交了上市申请(含新适应症),包括 7 个首次上市申请和 7 个新适应症申请。
从研发企业来看,14 款药中,进口药有 9 款,国产药有 5 款。药物类型上,化药和生物药各有 7 款。本文将节选其中几款潜在重磅抗肿瘤新药信息做介绍,仅供参阅。
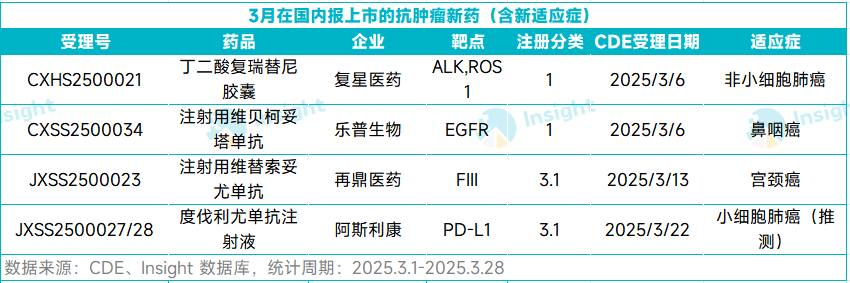
复星医药:复瑞替尼
将患者疾病进展或死亡风险减少 77%
3 月 6 日,复星医药子公司万邦医药的 1 类新药复瑞替尼上市申请获得 CDE 受理,用于治疗间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者。
复瑞替尼是一种在研的具有 CNS 高渗透性的 ALK/ROS1 抑制剂。其于 2015 年在国内首次批准临床,到如今报上市,该药的研发已历经了十年时间。
复瑞替尼有望解决 ALK 阳性 NSCLC 患者临床治疗中面临的耐药、疾病复发和中枢神经系统进展等问题。其针对该适应症的 III 期 REMARK 研究的期中分析结果曾入选了 2024 年 WCLC 的最新突破性摘要 (LBA)。这项试验的对照组为克唑替尼,主要终点为由 IRC 评估的无进展生存期(PFS)。
截至 2024 年 3 月,中位随访时间为 16.7 个月。克唑替尼治疗组的中位 PFS 为 13.93 个月,而复瑞替尼治疗组的 PFS 尚未达到。复瑞替尼治疗组的 PFS 相较于克唑替尼减少了 77% 疾病进展或死亡的风险。
同时,复瑞替尼显著降低了患者的 CNS 进展风险。克唑替尼治疗组中位 CNS-TTP 为 19.32 个月,而复瑞替尼组尚未达到。另外,复瑞替尼也有改善 OS 的趋势。
复瑞替尼组的 ORR 达到 92.8%,比克唑替尼组(80.9%)提高 12%(P=0.0035);对于基线脑转移的患者,复瑞替尼组的颅内 ORR 可达到 100%,而克唑替尼治疗组为 50%。
此外,复瑞替尼组也表现出了良好的安全性。
除了 ALK 阳性 NSCLC,复瑞替尼治疗 ROS1 阳性 NSCLC 已在中国境内完成 II 期临床研究。2022 年 12 月公布的 Ⅱ 期研究(NCT04237805)数据显示,复瑞替尼治疗 ROS1 阳性、未经 ROS1 抑制剂治疗的晚期 NSCLC 患者,ORR 高达 85.7%,颅内 ORR 高达 87.5%,且展现出了良好的安全性。
再鼎医药:维替索妥尤单抗
宫颈癌领域唯一获批的 ADC
3 月 13 日,再鼎引进的维替索妥尤单抗上市申请获得 CDE 受理,用于治疗系统性治疗期间或之后病情进展的复发或转移性宫颈癌患者。
维替索妥尤单抗是再鼎从 Seagen(现已被辉瑞收购)引进的一款靶向组织因子(TF)的 ADC。该药于 2024 年 4 月获得美国 FDA 完全批准,用于治疗在化疗期间或化疗后疾病进展的复发或转移性宫颈癌成年患者,是目前宫颈癌领域唯一一款获批的 ADC 疗法。
维替索妥尤单抗在国内的上市申请提交是基于全球随机 Ⅲ 期 innovaTV 301 临床研究(NCT04697628)的结果以及该研究中国亚组的结果。2025 年 1 月公布的数据显示:
与化疗相比,维替索妥尤单抗将患者死亡风险降低了 45%,这些患者曾接受过标准系统性治疗,其中超过一半的中国人群曾接受过抗 PD-1/L1 治疗。经过 11.5 个月的中位随访,化疗组的中位 OS 为 10.7 个月,而维替索妥尤单抗组的中位 OS 未达到。
在无进展生存期(PFS)和确认的客观缓解率(ORR)次要终点方面,维替索妥尤单抗组也优于化疗。
安全性方面,维替索妥尤单抗在中国亚组中的安全性是可控的,与全球研究概况一致。
乐普生物:维贝柯妥塔单抗
全球首个报产的 EGFR ADC
3 月 6 日,乐普生物重新递交的维贝柯妥塔单抗上市申请获得 CDE 受理。该申请已被纳入优先审评,用于既往经至少二线系统化疗和 PD-1/PD-L1 抑制剂治疗失败的复发/转移性鼻咽癌患者。
维贝柯妥塔单抗(MRG003)是一种靶向 EGFR 的 ADC,也是全球研发进度最快的 EGFR ADC。针对复发或转移性鼻咽癌,该药曾获得 CDE 授予突破性治疗药物、优先审评,以及 FDA 授予的孤儿药资格、快速通道资格、突破性疗法认定。
2024 年 9 月,乐普首次递交了维贝柯妥塔单抗用于鼻咽癌的上市申请。但因为要补充提交相关资料,乐普主动撤回了首次申请,并于今年 3 月重新提交了上市申请。
2023 年 ESMO 年会上,MRG003 在复发/转移性鼻咽癌患者中的 IIa 期研究(NCT05126719)数据公布。该研究入组的 61 名患者中,主要终点是客观缓解率 (ORR)。截至 2023 年 3 月 15 日,有效性数据显示:
在 DL2 队列中(2.3 mg/kg),有 29 名患者可评估,ORR 为 55.2% 。在三线鼻咽癌患者治疗中,这是个比较亮眼的数据,因为此前多项治疗该适应症的研究 ORR 数据一般在 30% 左右。
DL2 队列中,DCR 为 86.2%,中位 DoR (mDoR) 为 6.8 个月 ,中位 PFS 尚未成熟。研究最终选择 2.3 mg/kg 作为进一步关键研究的推荐剂量。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..