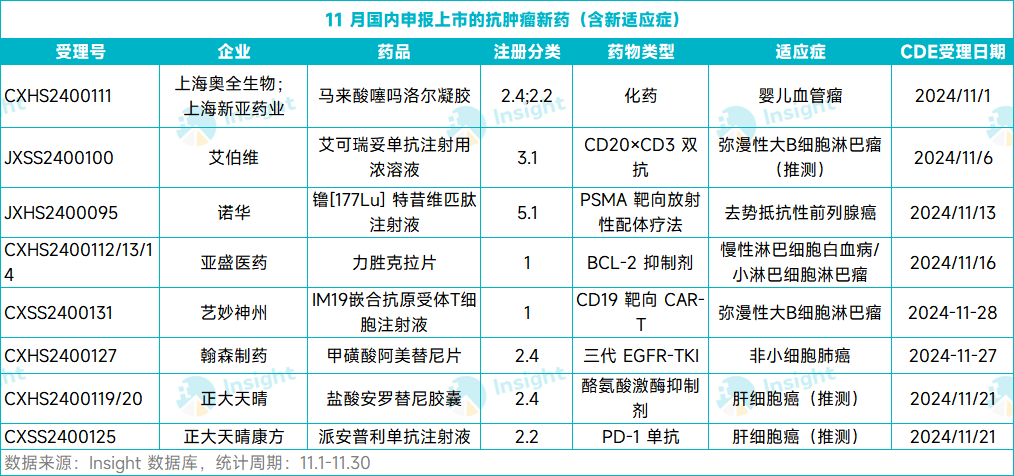
根据 Insight 数据库,在刚结束的 11 月,总计有 22 款新药向 CDE 递交了上市申请(含新适应症)。其中,有 8 款为抗肿瘤新药,包括 5 个新药的首次 NDA 和 3 款新药的新适应症 NDA。以下将节选 4 个首次申报 NDA 的抗肿瘤新药介绍,仅供参阅。
奥全生物:噻吗洛尔凝胶
首个报上市的婴幼儿血管瘤外用制剂
11 月 1 日,奥全生物的马来酸噻吗洛尔凝胶 NDA 获 CDE 受理,并被纳入优先审评,用于治疗增生期浅表型婴幼儿血管瘤。根据奥全生物新闻稿,这是全球首个申请上市的婴幼儿血管瘤外用制剂。
婴幼儿血管瘤是一种儿童时期常见的良性肿瘤,且女性多于男性,其中约 60% 发生于头颈部。目前,全球尚无治疗婴幼儿血管瘤的外用药物获批上市。
奥全的噻吗洛尔凝胶已在国内完成两项针对婴幼儿血管瘤的临床研究:
一项为Ⅰ期临床(CTR20181638),旨在健康中国成年受试者中评估单次、多次涂抹的马来酸噻吗洛尔凝胶后的安全性、耐受性;
一项为随机、双盲、安慰剂对照的 Ⅱ 期研究(CTR20200156),旨在评估马来酸噻吗洛尔凝胶治疗增生期浅表型婴幼儿血管瘤的有效性和安全性。
诺华:镥 [177Lu] 特昔维匹肽
PSMA 靶向放射性配体疗法
11 月 13 日,诺华的镥 [177Lu] 特昔维匹肽上市申请获 CDE 受理。该申请已被纳入优先审评,适用于治疗前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC) 、已接受雄激素受体通路抑制和紫杉类化疗的成年患者。
镥 [177Lu] 特昔维匹肽(177Lu-PSMA-617)是一款 PSMA 靶向放射性配体疗法,于 2022 年 3 月在美国获批上市(海外商品名 Pluvicto),是 FDA 批准的首个针对去势抵抗性前列腺癌患者的靶向放射性配体疗法。
关键性 III 期临床试验 VISION 结果显示:与标准治疗(SoC)相比,Pluvicto+SoC 可显著延长影像学无进展生存期(rPFS,8.7 vs 3.4 个月)和总生存期(OS,15.3 vs 11.3 个月)。而且,与 SoC 相比,Pluvicto+SoC 可降低患者的死亡风险,以及患者出现放射学疾病进展或死亡的风险。
Pluvicto 的市场表现也非常有潜力。上市后第二年(2023 年),它的销售额就达到了 9.8 亿美元,同比增速高达 263%。诺华最新三季报显示,2024 年前三季度,它的销售额已达 10.41 亿美元,成为了诺华的又一个重磅炸弹药物。
亚盛医药:力胜克拉
首个国产 BCL-2 抑制剂
11 月 16 日,亚盛医药力胜克拉片(APG-2575 片)上市申请获得 CDE 受理。该申请已被纳入优先审评,用于治疗难治或复发性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)患者。
Insight 数据库显示,BCL-2 抑制剂赛道,国内目前仅有艾伯维的维奈克拉获批上市,用于治疗急性髓系白血病(AML)。力胜克拉是首个报上市的国产 BCL-2 抑制剂。
23 年 ASH 年会上,亚盛公布了力胜克拉对接受过大量治疗的 CLL 患者的最新疗效和安全性结果。结果显示:
CLL 患者的 ORR 为 73.3%(33/45),CR/CRi 率为 24.4%(11/45),且 CR/CRi 率随剂量增加呈上升趋势。
外周血 MRD 检测患者中,38.9%(7/18)达到 MRD 阴性状态。通过骨髓 MRD 检测患者中,66.7%(4/6)为 MRD 阴性。
首次缓解中位时间为 2.07 个月,中位 PFS 为 18.53 个月,30 个月 OS 率为 86.3%,意味着力胜克拉具有为 CLL 患者带来长期生存获益的潜力。
此外,APG-2575 也在 R/R CLL 患者中表现出了良好的安全性和耐受性。
BCL-2 是血液肿瘤领域的热门靶点。除了维奈克拉和力胜克拉之外,国内还有十多款在研项目进入临床阶段,竞争最激烈的适应症领域是 CLL/SLL、AML。
其中,在 CLL/SLL 适应症领域,国内尚无 BCL-2 抑制剂获批,亚盛的力胜克拉是首个提交该适应症 NDA 的 BCL-2 抑制剂。这意味着,国产 BCL-2 抑制剂有望赶超外企,抢先在国内拿下 CLL/SLL 适应症。目前,亚盛还在探索力胜克拉在 CLL/SLL 一线治疗中的潜力。
艺妙神州:IM19 CAR-T 细胞注射液
CD19 靶向 CAR-T
11 月 28 日,艺妙神州的 IM19 CAR-T 细胞注射液(IM19)上市申请获 CDE 受理,用于治疗复发或难治弥漫大 B 细胞淋巴瘤(r/r DLBCL)。
IM19 CAR-T 细胞注射液是艺妙神州自主研发的首款血液肿瘤 CAR-T 细胞候选药物,已获得 NMPA 批准开展针对 3 个适应症的临床,包括复发/难治性 DLBCL、急性 B 淋巴细胞白血病(r/r B-ALL)、套细胞淋巴瘤(r/r MCL)。
本次上市申请是基于一项在中国进行的开放标签、单臂、多中心的确证性临床试验。该研究结果显示,IM19 治疗 r/r DLBCL 患者具有良好的疗效和安全性。今年 8 月,艺妙神州已与华东医药就 IM19 达成在中国大陆地区的商业化授权合作。
Insight 数据库显示,国内目前已有 6 款 CAR-T 获批上市,同时还有 3 款 CAR-T 正在上市申请中。艺妙神州的 IM19 是国内第 9 款报上市的 CAR-T。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..