本期看点
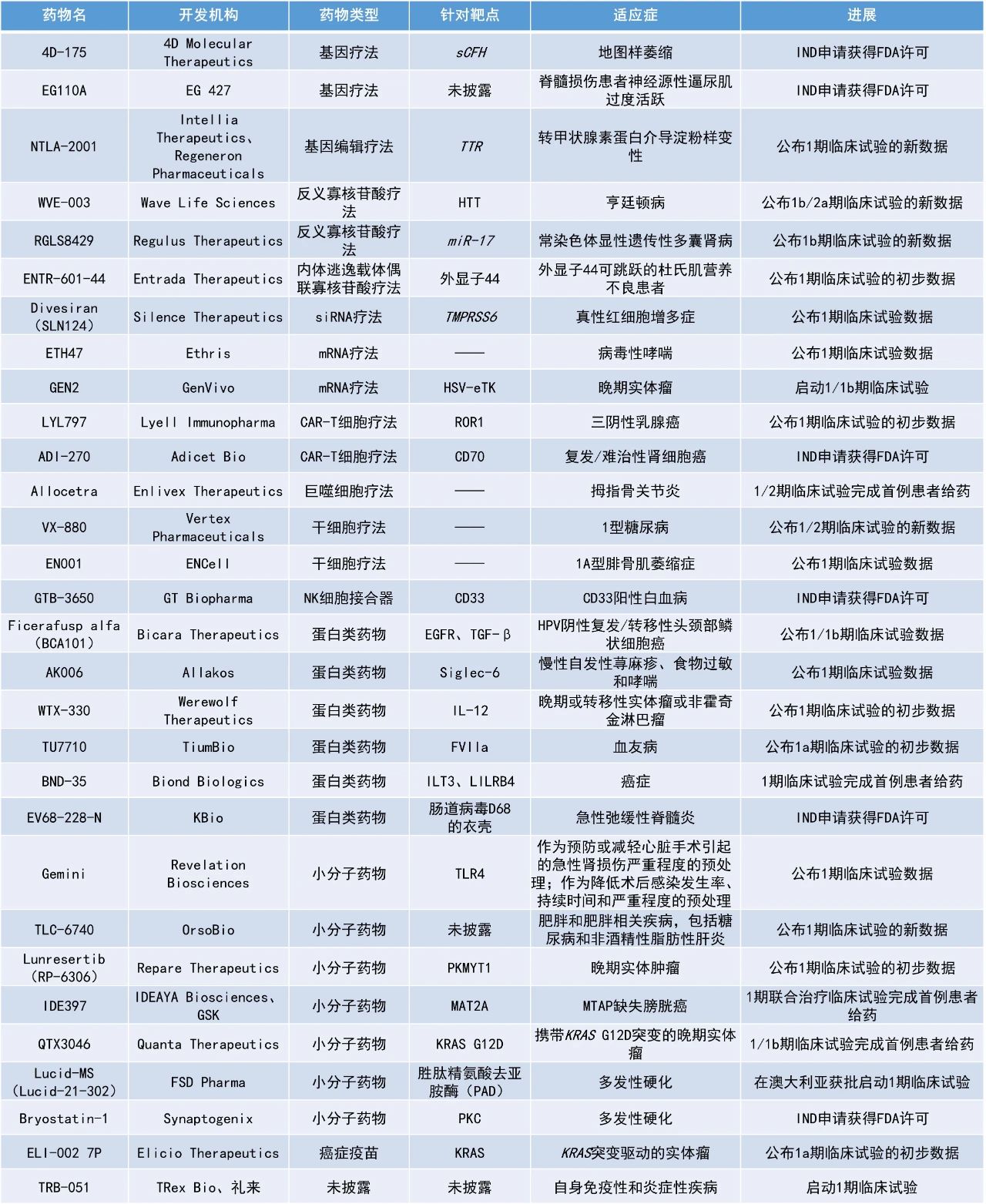
1. 干细胞疗法VX-880治疗1型糖尿病(T1D)患者在早期临床试验中获得积极数据,在末次随访时12名患者中有11名减少或停止使用外源性胰岛素。
2. 下一代寡核苷酸疗法RGLS8429用于治疗常染色体显性多囊肾病的早期临床试验结果积极,接受3 mg/kg剂量的患者中有70%的肾脏总体积缩小。
3. 通过抗耗竭技术增强的CAR-T细胞疗法LYL797在临床试验中被证明可以浸润到实体瘤中,治疗ROR1阳性复发/难治性三阴性乳腺癌患者的临床获益率(CBR)为60%。
药明康德内容团队整理
VX-880:公布1/2期临床试验的新数据
Vertex Pharmaceuticals公司公布了其在研细胞疗法VX-880治疗1型糖尿病的1/2期临床试验的最新数据。VX-880是一种在研干细胞来源、完全分化、产生胰岛素的同种异体胰岛细胞疗法。VX-880有可能通过恢复胰岛细胞功能,包括葡萄糖反应性胰岛素产生,恢复机体调节葡萄糖水平的能力。VX-880通过肝门静脉输注给药,需要长期免疫抑制治疗以保护输入的胰岛细胞免受免疫排斥。VX-880已获得美国FDA授予的再生医学先进疗法(RMAT)认定和快速通道资格,以及欧洲药品管理局(EMA)授予的PRIME资格。
公布的结果显示,在接受单次全剂量VX-880输注后90天内,所有T1D患者均显示出胰岛细胞移植成功和对葡萄糖反应的胰岛素生成。在最后一次随访时,12名患者中有11名减少或停止使用外源性胰岛素。Vertex预计增加入组患者数量,并将该疗法推进关键试验阶段。
RGLS8429:公布1b期临床试验的新数据
Regulus Therapeutics公司公布了其开发的新型下一代寡核苷酸疗法RGLS8429用于治疗常染色体显性多囊肾病的1b期临床试验的新数据。常染色体显性多囊肾病是由PKD1或PKD2基因突变引起的,也是最常见的人类单基因疾病之一,同时是终末期肾病的主要原因。RGLS8429旨在抑制miR-17并优先靶向肾脏,在临床前研究中已被证明能够明显改善肾脏功能、大小和其他疾病严重程度指标,并具有优越的药理学特征。此前,该公司已公布1期单次递增剂量临床试验的结果,结果显示,RGLS8429具有良好的安全性、耐受性和药代动力学(PK)特征。
此次公布的是1b期研究中第三个队列的结果,患者对RGLS8429的耐受性良好,未发现安全性问题。PC1和PC2是PKD1和PKD2基因的蛋白质产物,已被证明与疾病严重程度呈负相关。接受RGLS8429治疗患者的PC1和PC2与基线相比的百分比变化在所有测试剂量中均显示出缓解,与安慰剂相比,3 mg/kg剂量组具有统计学意义。探索性成像分析表明,3 mg/kg剂量组的患者中,70%的患者肾脏总体积缩小。
LYL797:公布1期临床试验的初步数据
Lyell Immunopharma公司公布了其第一代重编程ROR1靶向CAR-T细胞候选产品LYL797的1期临床试验的初步数据。LYL797采用了Lyell公司的抗耗竭基因重编程技术(c-Jun)和其专有的体外制造方法——表观遗传重编程技术(Epi-R)。LYL797过度表达c-Jun可以纠正耗竭T细胞中AP-1家族转录因子的失衡。在临床前研究中,c-Jun的过度表达使T细胞能够抵抗耗竭、浸润实体瘤并保持其功能。Epi-R技术旨在生成干样T细胞群,减少耗竭,提高增殖和抗肿瘤活性。
该研究的初始数据集主要由ROR1阳性复发/难治性三阴性乳腺癌患者组成。结果显示,LYL797对这些患者具有剂量依赖性的抗肿瘤临床活性,患者的客观缓解率为40%,CBR为60%。新闻稿指出,该试验首次证明了通过抗耗竭技术增强的CAR-T细胞既可以增殖又可以浸润到实体瘤中。在无肺部受累的患者中未观察到与LYL797相关的显著安全信号;在肺转移性疾病患者中观察到可治疗的肺炎。根据现有的积极数据,该公司计划扩大开发范围,包括ROR1阳性复发/难治性铂类耐药卵巢癌、子宫内膜癌、多发性骨髓瘤和慢性淋巴细胞白血病等新肿瘤类型。
NTLA-2001:公布1期临床试验的新数据
Intellia Therapeutics公司公布了其CRISPR/Cas9基因编辑疗法NTLA-2001的最新临床数据。NTLA-2001是Intellia与再生元(Regeneron)开展的多靶点发现、开发和商业化合作的一部分,Intellia负责主导NTLA-2001的开发和商业化。之前新闻稿指出,NTLA-2001以CRISPR/Cas9技术为基础,有望成为治疗转甲状腺素蛋白(ATTR)淀粉样变性的首个单次给药疗法。此外,NTLA-2001是首个通过全身给药或静脉注射来编辑人体内基因的候选CRISPR基因编辑疗法,基于Intellia公司专有的非病毒平台,利用脂质纳米颗粒(LNP)向肝脏输送由两部分组成的基因编辑系统:靶向血清转甲状腺素(TTR)基因的特异性gRNA和编码Cas9酶的mRNA。
此次公布的结果显示,三位先前在1期剂量递增研究中接受最低剂量NTLA-2001治疗的ATTR淀粉样变性患者,在接受后续55 mg NTLA-2001治疗后,其TTR蛋白水平中位减少90%。根据新闻稿,这是首次临床数据显示体内CRISPR/Cas9基因编辑疗法可有效重复给药,成功完成临床概念验证。
WVE-003:公布1b/2a期临床试验的新数据
Wave Life Sciences公司宣布,在研疗法WVE-003在治疗亨廷顿病(HD)的1b/2a期临床试验SELECT-HD中取得了积极成果。WVE-003是一款等位基因选择性反义寡核苷酸,旨在降低突变亨廷顿蛋白(mHTT)表达并保留健康的野生型亨廷顿蛋白(wtHTT)。
数据显示,WVE-003总体安全性和耐受性良好,没有报告严重不良事件。在28周评估期间观察到WVE-003组患者显著的mHTT蛋白水平降低:在24周(最后一次给药后8周),脑脊液(CSF)中mHTT与安慰剂组患者相比平均降低46%(p=0.0007);在28周(最后一次给药后12周),CSF中mHTT平均降低44%(p=0.0002),支持每季度或更少频率的给药。尾状核萎缩是一个影像学生物标志物,可预测患者的临床结果,包括总运动评分(TMS)的临床显著恶化。在24周(最后一次影像评估)时,mHTT的减少与尾状核萎缩的减缓相关(R=-0.50;p=0.047)。
ENTR-601-44:公布1期临床试验的初步数据
Entrada Therapeutics公司公布了其用于治疗杜氏肌营养不良(DMD)的候选疗法ENTR-601的1期临床试验的积极初步数据。ENTR-601-44是一种专有的内泌体逃逸载体(EEV)偶联磷酸二酰胺吗啉寡聚物(PMO),旨在解决由于DMD基因突变或缺失外显子而导致的DMD的根本原因。ENTR-601-44可用于治疗DMD患者中可跳过44号外显子的患者,目前正在评估其恢复mRNA阅读框的潜力,并允许翻译略有缩短但仍有功能的肌营养不良蛋白。
此次公布的结果显示,ENTR-601-44在健康受试者中耐受性良好,没有严重的不良事件,没有与药物相关的不良事件,也没有在生命体征、心电图、体格检查或实验室评估中观察到临床显著的变化或趋势。研究人员在接受ENTR-601-44的患者的肌肉中检测到了药物浓度。与接受安慰剂的患者相比,ENTR-601-44组患者的外显子跳跃水平具有统计学意义。
Divesiran(SLN124):公布1期临床试验数据
四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..