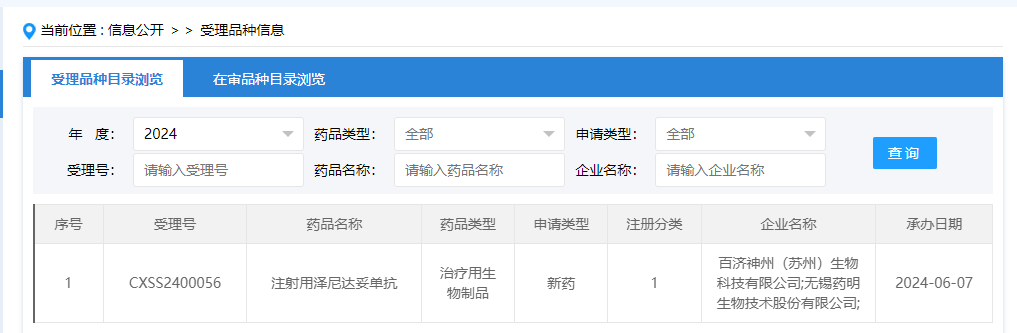
6月7日,CDE网站显示,百济神州HER2双抗泽尼达妥单抗(zanidatamab)上市申请获得受理。2023年11月,该产品被纳入优先审评,适应症为治疗既往接受过全身治疗的HER2高表达的不可切除局部晚期或转移性胆道癌患者。
泽尼达妥单抗是一种新型的HER2靶向双特异性抗体。与曲妥珠单抗相比,泽尼达妥单抗在不同HER2过表达的肿瘤细胞类型和不同HER2表达水平下具有更强的体外和体内抗肿瘤活性。来自人类细胞系和动物模型的结果表明,泽尼达妥单抗也可能对HER2低表达的肿瘤具有临床活性。
2023年6月,百济神州在ASCO大会公布了IIb期HERIZON-BTC-01研究结果。这是一项开放标签的全球性IIb期研究,共纳入了87例既往接受过含吉西他滨治疗的HER2扩增局部晚期不可切除或转移性胆道癌患者。研究主要终点是HER2阳性队列通过独立中心审查(ICR)确认的客观缓解率(cORR),次要终点包括其它疗效和安全性数据。
研究结果显示,在HER2阳性患者中,cORR为41%,中位反应持续时间(DOR)为12.9个月;中位研究随访时间为12.4个月。截止2022年10月10日,在33名应答者中,49%患者有持续应答,82%患者DOR≥16周。首次应答中位时间为1.8个月。
安全性方面,72%的患者发生了治疗相关不良事件(TRAE);≥10%的患者TRAE为腹泻(37%)和输液相关反应(33%)。3级TRAEs发生在18%的患者中。2名患者因不良事件而停用泽尼达妥单抗,7名患者发生严重TRAE。
今年ASCO大会上,该研究首次公布了总生存期(OS)数据。长期随访结果显示,zanidatamab治疗组患者的中位OS达到了15.5个月。目前,FDA已经接受zanidatamab的生物制品许可申请(BLA)并授予其优先审评资格,PDUFA日期为2024年11月29日。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..