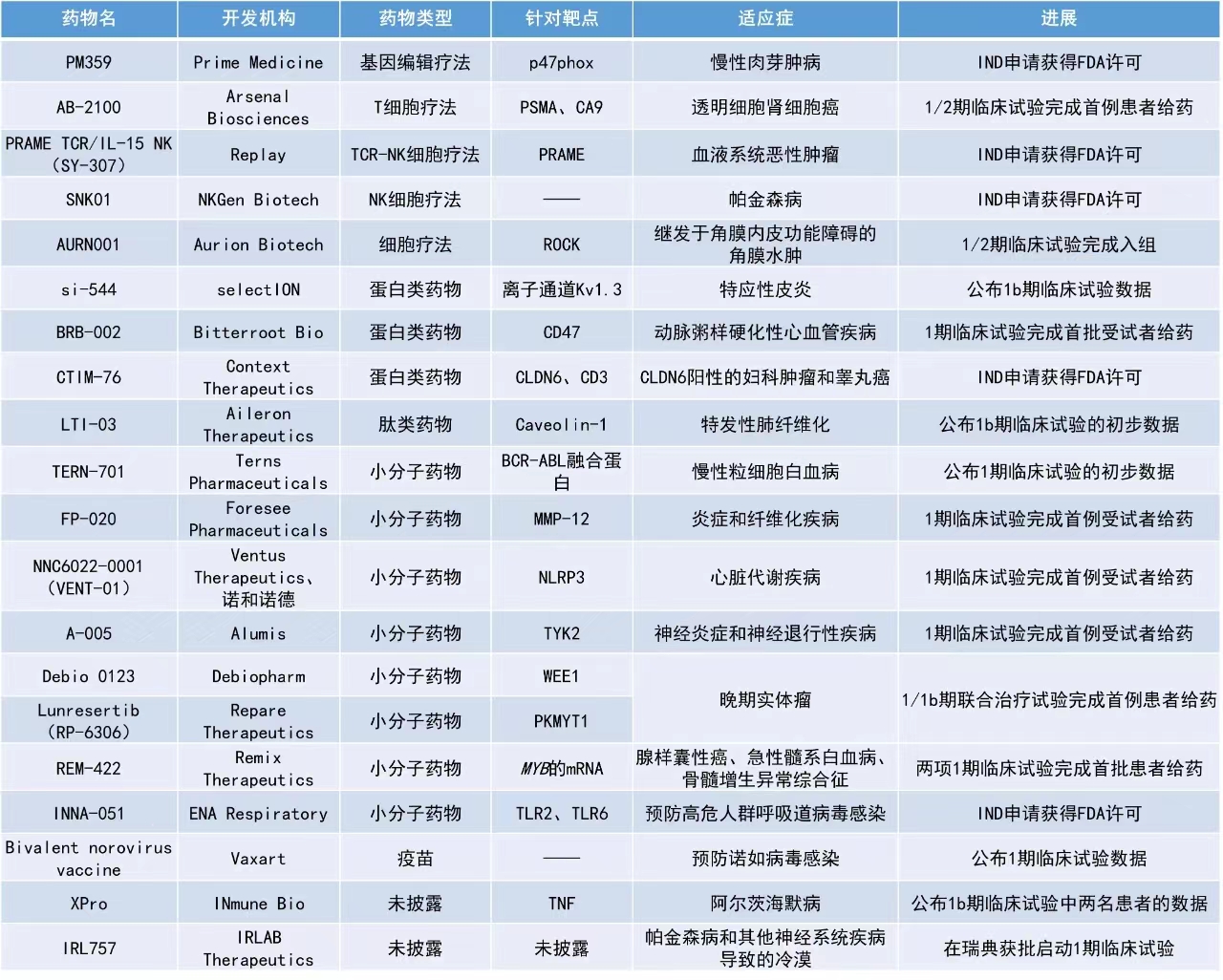
1. 治疗特应性皮炎的选择性肽疗法si-544的1b期临床试验结果积极,75%的患者的临床症状有客观改善。
2. 下一代精准靶向疗法XPro使两名阿尔茨海默病患者的认知功能保持稳定超过3年。
3. 美国FDA批准了在研先导编辑(prime editing)疗法PM359用于治疗慢性肉芽肿病(CGD)的IND申请,标志新一代基因编辑技术临床转化的重要里程碑。
药明康德内容团队整理
si-544:公布1b期临床试验数据
selectION公司公布了其候选药物si-544在轻度至重度特应性皮炎患者中的1b期临床试验数据。si-544是一种选择性经优化的多肽疗法,可阻断离子通道Kv1.3。Kv1.3是一种参与效应记忆T(TEM)细胞激活和增殖的特殊离子通道。TEM细胞是许多自身免疫性疾病(如特应性皮炎、银屑病、类风湿性关节炎或多发性硬化)及某些罕见癌症(如淋巴瘤)的根源。在临床前研究中,si-544表现出了良好的疗效。该候选疗法通过在功能上抑制和消除疾病特异性、慢性激活的TEM细胞,同时保持完全的免疫能力,有望解决重大的未竟医疗需求。
此次公布的结果显示,si-544的耐受性良好,没有观察到严重的不良反应、剂量限制毒性或安全信号。在接受si-544治疗的患者中,75%的患者的临床症状得到了客观改善,其中44%的患者在监测期结束时,皮肤变得光洁或接近光洁。用药后,这种改善的趋势维持了整个监测期。
XPro:公布1b期临床试验中两名患者的数据
INmune Bio公司公布了两名在完成1b期试验后继续接受XPro治疗超过3年的阿尔茨海默病患者的最新情况。XPro是一款旨在中和可溶性肿瘤坏死因子(TNF)的下一代精准靶向疗法。该候选疗法不会干扰促进正常功能和修复的TNF形式,这种特异性大大提高了有效性和安全性。
两名阿尔茨海默病患者在完成为期3个月的开放标签试验和12个月的扩展试验后,在澳大利亚同情使用计划下继续接受XPro治疗超过三年。此次公布的结果显示,XPro长期给药的安全性和耐受性良好,这些患者已在持续的XPro治疗中保持稳定的认知功能超过3年。
PM359:IND申请获得FDA许可
Prime Medicine公司宣布,该公司为在研先导编辑疗法PM359递交的IND申请已经获得美国FDA的许可,用于治疗慢性肉芽肿病。这使该公司能够启动全球性的1/2期临床试验。新闻稿指出,这是先导编辑技术首个获得许可的IND,标着新一代基因编辑技术临床转化的重要里程碑。
PM359是Prime Medicine在血液学和免疫学领域的首个候选疗法,针对的是慢性肉芽肿病的p47phox变体。PM359通过先导编辑器在体外修改自体造血干细胞(HSCs)。临床前研究显示,这些编辑器可以高效率纠正携带病因突变细胞的DNA。PM359已获得美国FDA授予的罕见儿科药物认定和孤儿药资格。
二价诺如病毒候选疫苗:公布1期临床试验数据
Vaxart公司公布了其口服二价诺如病毒候选疫苗片剂的1期临床试验的顶线结果。该候选疫苗的使用对象是处于哺乳期的母亲,旨在通过母乳将诺如病毒抗体从母体转移到婴儿,从而潜在地提高婴儿对诺如病毒感染的抵抗力。
研究人员在这项研究中观察到哺乳期的母亲及其母乳中的抗体升高。在高剂量组母亲的母乳中,针对诺如病毒GI.1病毒株的抗体平均升高了4.0倍,针对GII.4病毒株的抗体平均升高6.0倍。安全性方面,没有出现与疫苗相关的严重不良事件,也没有出现剂量限制性药理毒性。
LTI-03:公布1b期临床试验的初步数据
Aileron Therapeutics公司公布了其用于治疗特发性肺纤维化(IPF)吸入性疗法LTI-03的1b期临床试验数据。LTI-03是一种新型的Caveolin-1相关多肽,由7个氨基酸组成,可抑制促纤维化信号传导并帮助关键上皮细胞存活。
此次公布的结果显示,LTI-03低剂量组患者在接受治疗后,病理性基底样细胞和成纤维细胞中多种促纤维化蛋白的表达降低,与上皮健康相关生物标志物的表达增加。作为评估指标的8种生物标志物中,有7种表现出了积极趋势,其中3种具有统计学意义。安全性方面,低剂量LTI-03的耐受性良好,未观察到安全信号。LTI-03高剂量组的数据预计将于2024年第三季度公布。
REM-422:两项1期临床试验完成首批患者给药
Remix Therapeutics公司宣布,其潜在“first-in-class”的MYB mRNA降解剂REM-422的两项1期临床试验均已完成首批患者给药。MYB是多种实体瘤和血液恶性肿瘤的致癌驱动因子。REM-422是一种强效、选择性口服小分子mRNA降解剂,通过促进mRNA转录本掺入毒性外显子,引发无义介导的mRNA降解(NMD),可减少MYB mRNA及随后的蛋白表达,从而在MYB依赖性人类肿瘤模型中产生抗肿瘤活性。
目前,REM-422正在一项针对复发或转移性腺样囊性癌(ACC)患者的1期临床试验和一项针对复发/难治性急性髓系白血病(AML)或高危骨髓增生异常综合征(MDS)患者的1期临床试验中接受评估。该公司还宣布,美国FDA授予了REM-422孤儿药资格,用于治疗ACC和AML。
SNK01:IND申请获得FDA许可
NKGen Biotech公司宣布,美国FDA已批准其在研自然杀伤(NK)细胞疗法SNK01用于治疗帕金森病的IND申请。SNK01是一款自体、非基因工程改造的NK细胞产品。它具有增强的细胞毒性和激活性受体的表达,有望成为治疗帕金森病的一种新方法。该公司预计将于2024年下半年启动针对帕金森病的1期临床试验。
PRAME TCR/IL-15 NK(SY-307):IND申请获得FDA许可
Replay公司和MD安德森癌症中心共同宣布,美国FDA已批准PRAME TCR/IL-15 NK(SY-307)的IND申请。PRAME TCR/IL-15 NK(SY-307)是一种由脐带血NK细胞开发而成的,用于治疗复发/难治性髓系恶性肿瘤的工程化T细胞受体(TCR)NK细胞疗法。这些细胞表达针对PRAME肿瘤相关新抗原的高亲和力TCR。PRAME具高免疫原性,在多种不同类型的癌症中都有表达,包括AML和MDS等血液系统恶性肿瘤,以及黑色素瘤、肉瘤、卵巢癌、子宫内膜癌、肺癌和乳腺癌等实体瘤。该候选疗法用于治疗复发/难治性AML和MDS患者的1/2期研究预计将于2024年第三季度启动。
INNA-051:IND申请获得FDA许可
ENA Respiratory公司宣布,美国FDA已批准其新型toll样受体2/6(TLR2/6)激动剂INNA-051干粉制剂的IND申请。INNA-051是一种不受病毒类型限制的鼻内抗病毒宿主防御免疫调节剂,是TLR2/6的强效潜在“first-in-class”激动剂。TLR2/6在识别病原体和触发先天性免疫反应中发挥着关键作用。此前,ENA Respiratory公司在流感模型中进行的2a期研究结果表明,INNA-051液体制剂能加速病毒清除并局部激发宿主的抗病毒防御能力。在此基础上,该公司开发了改进的干粉制剂,旨在为呼吸道病毒感染高危人群(包括老年人、患有基础疾病的人和有职业风险的人)提供一种方便的、每周仅需使用一次的鼻腔给药产品,以预防与呼吸道病毒感染相关的并发症。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..