创新药的研发工作以消耗资金巨大,耗时漫长而且具有较高的失败率而被行业称为向死而生的工作。那些已经获得各国药政机构批准的幸运儿本来就稀少,而有些产品即使侥幸获得批准,如果上市后表现一般或者没有完成药政机构要求的后续研究任务,或者研究数据很不理想,也会再次被注销。本文将汇总过去几年美国FDA针对已上市药品再次撤销批准的产品数据,为药界同仁参考。
第一部分:Pepaxto批准又撤市的悲惨故事
2024年2月23日,FDA发布了最终决定,撤销了Pepaxto (melphalan flufenamide)的批准。该决定由FDA的CBER主任Peter Marks作为委员会负责人员来发布此消息。这也是FDA首次使用2023年颁布的修订后的加速审批撤销程序(《2022 年食品和药品综合改革法案》(FDORA)的一部分)。Pepaxto撤市理由如下:(1)作为加速批准条件进行的验证性研究没有证实Pepaxto的临床获益;(2)现有证据表明,Pepaxton在其使用条件下没有被证明是安全或有效的(图1)。

图1 FDA对Pepaxto的最终撤销决定(图源FDA官网)
Pepaxto撤市始末
Pepaxto是Oncopeptides公司研发的一款靶向氨肽酶(aminopeptidase)的PDC药物,也是FDA批准的首款抗癌多肽偶联药物(PDC),于2021年2月26日获得FDA加速批准,联合地塞米松治疗R/R MM患者。药物获批的同时FDA要求Oncopeptides继续开展验证性III期OCEAN试验。之后Pepaxto的验证性临床试验OCEAN报告了令人失望的结果。该试验不仅未能达到总生存期(OS)的临床终点,且Pepaxto治疗组患者的死亡人数比对照组更高(总体生存/风险比1.104)。FDA由此暂停了Pepaxto的试验,之后发布了 Pepaxto 的安全警示并决定在2021年10月28日召开肿瘤药物咨询委员会(ODAC)会议,对Pepaxto的安全性进行评估。
未等到FDA专家会召开, 2021年10月22日,Oncopeptides宣布主动从市场撤下Pepaxto。但在2022年1月,Oncopeptides表示撤回Pepaxto退市的申请,要“与FDA密切沟通,重新审查临床数据”。但美国监管机构对Oncopeptides新的分析结果并不认同,Pepaxto仍需要接受审判。2022年7月20日,FDA再次宣布召开ODAC以对Pepaxto的受益/风险进行评估。
2022年12月7日,FDA遵循了专家会成员的意见,正式宣布撤销对Pepaxto的加速批准,禁止其在市销售。2023年8月,Oncopeptides对FDA的撤回提出了上诉。2月23日的这一决定是FDA对此上诉的回应。根据新修订的加速审批撤销程序,FDA向Oncopeptides出具了拟议撤回批准的通知、拟议撤回的解释、会议机会以及向专员(或指定人员)提出书面上诉。Oncopeptides提交书面申诉后,并会见了专员的指定人员。
第二部分:美国市场上其他获得批准又撤销的药品故事
FDA最早于1992年为了应对HIV/AIDS 危机,而设立加速批准(Accelerated Approval ,AA)。2012年加速批准写入食品药品安全与创新法案(FDASIA) 之后,加速批准的数量开始明显增加,其中以抗肿瘤药物为主(图2)。
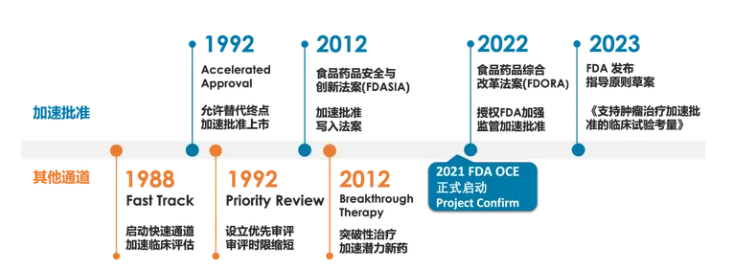
图2 FDA加速批准的变革
加速批准(Accelerated Approval ,AA)与传统批准相较而言,药物上市的中位时间提前了3.1年,因此也成为众多肿瘤新药上市的主要途径。但加速批准这种途径在执行过程中也有诸多争议,主要集中在以下三个方面:替代终点的临床获益验证,完成确证性研究的时间,以及验证失败药物的撤市问题。
截止目前为止,FDA撤销的加速批准的药物共27种,汇总如下,供大家参考。
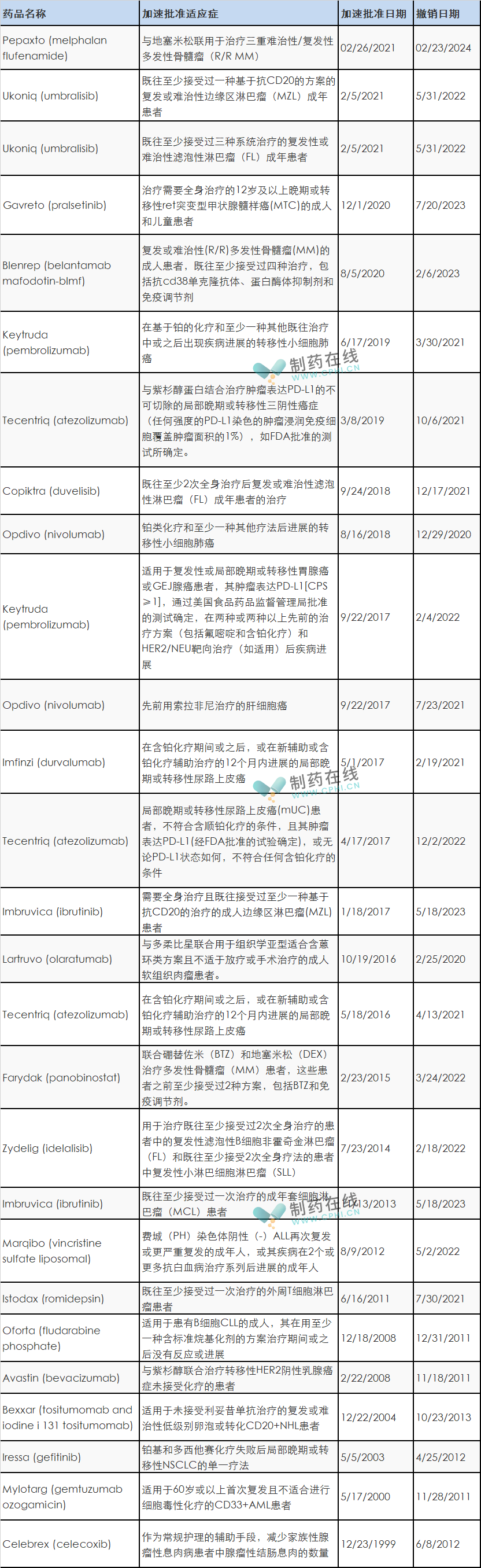
分析
从上面的这些药品的悲惨故事,可以看出美国FDA对于药品加速批准和撤销的程序日趋完善,优秀药品获批通道和不良药品退出通道都非常清晰。这一点,中国NMPA应该学习,并尽快完善国内相关的退出机制。
参考信息
1-FDA官网信息。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..