持有人应当设立职责清晰的管理部门,配备与药品生产经营规模相适应的管理人员,按规定建立覆盖药品生产全过程的质量管理体系。
过去一年,药品上市许可持有人(MAH)制度险些遭遇“开倒车”危机。
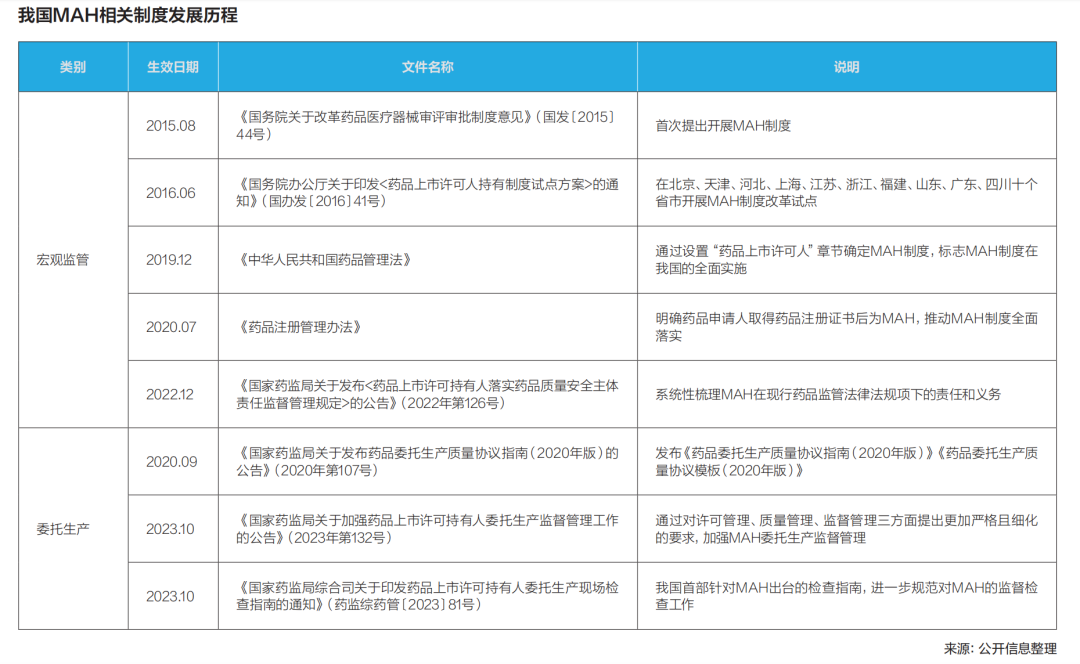
2015年,MAH制度被引入国内,此后经历了在十个省份长达四年的试点;2019年,这项制度被写入《药品管理法》,在全国推广。MAH制度的全面推开,是解放制药企业生产力、促进行业资源流动和整合的重要举措,也是和国家药品监督管理局(NMPA)国际药品监管体系接轨的重要标志。
中国医药行业向专业化、分工配合的趋势转变,正是从《药品管理法》第三十二条的“药品上市许可持有人可以自行生产药品,也可委托药品生产企业生产”开始的。
MAH制度极大地激发了国内创新型药企的研发动力,改变了医药行业产能过剩的情况,同时极大地降低了企业的营运成本,更好地提升产品的市场竞争力。在MAH制度下,医药研发类公司可以利用有限的资源,在新药风险尚未释放的情况下,通过委托生产的方式开展新药研发。也正是在这种分离式管理之下,药品上市许可与生产许可不再被捆绑,医药创新研发也进入了“快车道”。
从“上市许可和生产许可捆绑式管理”到“MAH制度的上市许可和生产许可分离式管理”,对Biotech公司而言,MAH制度下的分离式管理可以让持有人专心搞研发,把生产委托给持有《药品生产许可证》的生产企业来做,在产业内形成“各司其职”的生态。
然而正是这一国内医药创新快速生根发芽的沃土,在委托生产制度实施的过程中,不断暴露出了一些质量管控方面的问题,差点让监管上演了一场开“政策倒车”的黑天鹅事件。
“剜”委托生产暗疮
从去年4月的业内流传出“药监部门在针对Biotech是否应当具备自行生产能力征求行业意见”引发业界直呼“已经是资本寒冬了,如果必须拿出一部分钱来建厂、买设备,有的公司可能会被逼到绝境。”到去年5月的《关于加强委托生产药品上市许可持有人监管工作的通知(征求意见稿)》取消了对除疫苗、血液制品外的生物制品持有人自行生产能力的强制要求,但同时也对MAH全产业链条参与方做出了更为详细、严格的全过程质量管理要求;再到去年10月正式发布的《国家药监局关于加强药品上市许可持有人委托生产监督管理工作的公告》(以下简称“132号文”),被称为最严、最细的委托生产文件,NMPA肃清MAH委托生产乱象、正本清源的决心不言而喻。
MAH作为药品上市许可持有人,需要对药品整个生命周期全面承担责任,必须具备保障药品安全性、有效性和质量可控性的质量管理、风险防控体系和责任赔偿三大方面的能力。
我国当前药品生产许可证包括A、B、C、D证四种,其中A证代表自行生产的药品上市许可持有人,批准文号拥有者和生产企业相同;B证代表委托生产的药品上市许可持有人,表示上市许可持有人自身不从事药品生产活动,而是将药品生产活动委托给生产企业进行;C证代表接受药品上市许可持有人(批准文号拥有者)的委托,生产该种药品的企业。生产企业在接受委托生产活动时,不论其是否取得了A证,都必须取得C证,无法用A证代替。D证则代表原料药生产企业。
对于持有人为委托生产企业(B证)来说,持有人虽不生产药品,依然必须对药品质量全生命周期负责。通过与受托方(C证)签订质量协议和委托协议,定期对受托企业进行定期审核、监督。根据相关规定,核发B类许可证对申请人开展现场检查,重点检查申请人关键岗位人员配备和在职在岗情况、质量管理体系建设和运行情况、对委托生产的管理情况等内容,确认申请人具备履行药品质量安全主体责任的能力。
但现实并非如此。浙江一家B证持证企业负责人直言,很多B证企业找寻的代工企业也都是中小工业企业,授权了就当“甩手掌柜”,对品种质量管控不管不问,受托企业也觉得订单不大不重视。
隐藏在“MAH制度释放了产业活力、加快了医药行业产业分工细化的进程”高光之下的质量管理“暗疮”正在发作。
132号文对委托生产的许可管理、质量管理及监督管理均提出高标准、严要求,与《检查指南》《持有人监管规定》等制度多措并举、协同发力,在督促MAH委托生产落实主体责任,保证药品全生命周期质量安全,推动医药产业高质量发展等方面均带来重要意义。在对药品委托生产主体责任监管逐步加强的背景下,企业在实际运营中挑战与机遇并存,MAH在委托生产活动中要谨慎选择受托生产线,储备关键岗位人员,优化文件与记录管理,对照要求开展全面自查,以提升质量管理水平和持续合规能力。
“算是中国医药产业发展中,一放就乱、一管就死的再次展现”,一位长期关注MAH制度建设的行业人士直言,各省份对B证持有人的申请审核,标准不一、松紧各异,但万变不离其宗,对上市许可持有人的B证资质审核会趋严,应该做到从入口把关。
尤其是在132号文出台之后,下一步就要观察各省的落实情况了。“每个省份的药监部门对政策的理解、标准尺度的把握、组织专家对企业进行核查的能力或多或少都会存在差异。”
但同时他也认为,“从准入环节严控,既可以让试图钻空子的B证企业知难而退,药监部门也能够帮助到真正有创新能力的B证企业健全自身的质量管理体系。”
对关键人物岗位要求更高
对于规规矩矩做事的B证公司而言,不仅不担心被药监部门卡脖子,对132号文的落地更是“喜闻乐见”。广东一家B证企业负责人直言,MHA制度下监管的难点是质量管理体系,如今监管部门对质量授权人提出了更高的要求,对监督检查规范的统一、跨省监督等方面都提出了的新要求,这些措施的目的都是为破解监管难点,完善产品质量管理。
“人”是MAH质量监管体系与能力建设中最核心的要素,药企质量负责人、受权人等五个岗位是药品全生命周期质量和风险管控的关键岗位之一,肩负着“建立持有人质量控制管理体系、监督生产中的质量控制、管理培训企业质量人员、乃至履行药品放行”的职责,承担着守护产品质量的重任。
如此重要的岗位,却是B证核发检查中常常发生问题的重灾区。2021年7月,广东省药品监督管理局审评认证中心对该省30家B证申报方现场检查发现的260条缺陷进行了分析,其中,质量管理体系建设存在缺陷条数占比63%,机构与人员存在缺陷条数占比25%;江苏省也曾对受理的31家研发机构的B类药品生产许可证核发申请时,发现91项问题,主要集中在“研发机构型药品上市许可持有人本身存在商业化生产经验少、委托生产管理能力不足、质量意识淡薄”“对于履行药品安全第一责任人的职责尚存在差距”等方面。
对药企来说,建立一套完善的质量管理体系对产品的整个生命周期中影响产品质量的所有因素进行管理,既包括对受托方的监管,也包括上市后的药物警戒,从而对产品的质量提供全面有效的保证。
但从现实来看,以专人专职实施药品全生命周期质量管理的效果不尽如人意。
来自浙江省药监局的统计数据显示,浙江省内接受审评的B证企业中,企业规模不足20人的公司占比达到60%。对此浙江省药品监督管理局副局长陈魁曾公开表示,这些企业履行B证企业全生命周期质量管理能力、风险防控能力、责任赔偿能力难以把控。
浙江省的统计数据便是如今产业的缩影,尤其是对很多中小规模的B证持证企业来说,设立药品质量监管的专职人员,对企业的运行而言,具有较大“负担”。这种负担之下,委托生产中监管能力的缺失,或者说药品上市许可持有人无法建立起完善的质量管理体系的矛盾在持B证的企业中凸显。
多位B证企业负责人表示,132号文在强化委托生产的机构与人员监督管理方面,对机构和人员的要求更高了。这也给企业建立健全组织机构,配备关键岗位人员,梳理明确责任清单,建立覆盖药品研制、生产、经营、使用全过程的质量管理体系提出了明确的高要求。
具体来看,持有人应当设立职责清晰的管理部门,配备与药品生产经营规模相适应的管理人员,按规定建立覆盖药品生产全过程的质量管理体系。
不同产品类型的B证持证企业,其委托生产的要求也做了明确区分。委托生产无菌药品的,持有人的生产负责人、质量负责人、质量受权人均应当具有至少五年从事药品生产和质量管理的实践经验,其中至少三年无菌药品生产和质量管理的实践经验,委托生产中药注射剂、多组分生化药的,持有人的生产负责人、质量负责人、质量受权人应当具备同类型制剂产品三年以上生产和质量管理的实践经验。
对于长期被诟病的“委托人无法对受托人进行质控管理”的问题,如今NMPA也给出了明确的界定:生物制品、中药注射剂、多组分生化药委托生产的,持有人应当持续提升全过程质量管理水平,在委托生产药品期间,持有人应当选派具有相关领域生产和质量管理的实践经验、熟悉产品生产工艺和质量控制要求的人员入驻受托生产企业,对产品生产管理、质量管理全过程进行现场指导和监督,确保生产工艺、质量标准等符合法规要求;派驻人员工作职责应当在质量协议中予以明确。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..