2024年1月8日,FDA的CDER发布了《2023年新药治疗审批报告》,从这个审批报告中我们可以了解到,2023年FDA批准了55种创新药物,这个数量远超于2022年的37种。另外,值得我们注意的是这55款获批新药中单孤儿药就高达28个,占获批药物总数的51%(详见图1)。
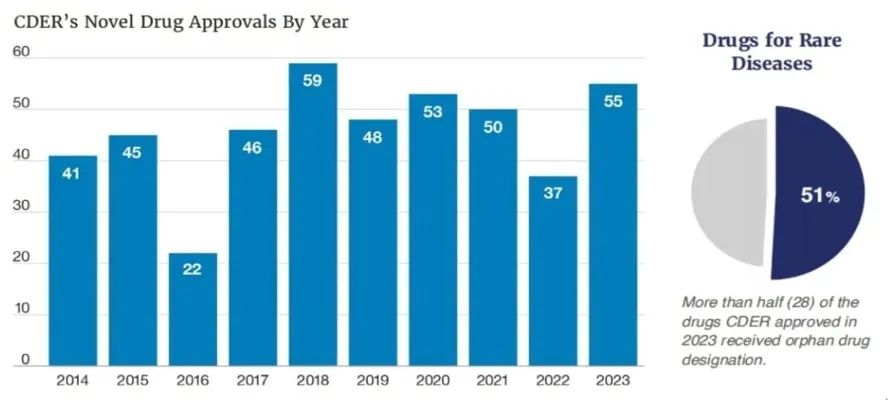
图1 CDER各年度新药批准数量
美国于1983年颁布了《孤儿药法案》,成为世界上第一个为罕见病药物立法的国家。之后为了鼓励罕见病药物的研发,美国通过了孤儿药认定(Orphan Drug Designation, ODD)计划的一系列政策。孤儿药认定(Orphan Drug Designation, ODD)就是FDA 孤儿药产品开发办公室(Office of Orphan Products Development, OOPD) 对符合条件的用于预防、治疗及诊断罕见病的药物(包括生物制品)授予的一种资格认定。
近年来,国内多家生物医药公司开发的创新药在美国获得孤儿药资格认定,本文我们就盘点一下2023年中国制药企业获得FDA孤儿药资格认定的创新药。
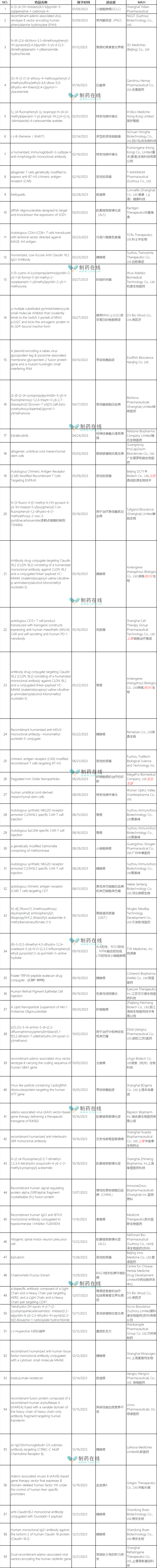
根据FDA的孤儿药认定数据库资料初步统计,2023年获得FDA授予的孤儿药认定的创新药共有376种,其中中国的创新药占59种(按适应症计),约占15%(详见表1)。
国内制药企业获得FDA孤儿药资格认定的这些产品,从其适应症领域来看,多集中在肿瘤领域,占比高达63%(37/59),数量最多的5个癌种依次是胰腺癌(9项)、胃癌(5项)、恶性胶质瘤(4项)、小细胞肺癌(3项)、胆道癌(2项)。除此之外,肌萎缩侧索硬化症和亨廷顿舞蹈症关注度也较高。
另外,这些产品涵盖了CAT-T疗法、抗体偶联药物(ADC)、双特异性抗体、基因疗法等创新疗法。
值得注意的是,有多家公司的多个产品同时被授予孤儿药资格认定。例如博安生物自主开发的两款靶向Claudin18.2的在研产品--创新抗体BA1105、创新抗体偶联药物BA1301获得FDA授予的治疗胰腺癌适应症的孤儿药资格认定;Suzhou Immunofoco Biotechnology Co., Ltd(易慕峰)是一家致力于突破实体瘤治疗,给患者带来长期生存获益的免疫细胞治疗药物开发企业,其自主研发的靶向EpCAM的自体CAR-T细胞注射液产品获得FDA授予的治疗胃癌适应症的孤儿药资格认定,时隔不久该产品又被FDA授予孤儿药资格认定,用于治疗胰腺癌患者;德琪(杭州)生物自主研发和开发的Claudin 18.2抗体偶联药物(ADC)ATG-022获FDA先后授予的两项孤儿药资格认定,分别用于治疗胃癌及胰腺癌。
表1 2023年获得FDA授予孤儿药资格认定的中国药企及产品
分析
从上面这些数据看,国内创新药企业对美国孤儿药的政策很熟悉,并且充分运用。对于研发成本高启的美国医药市场,可以通过孤儿药资格认定这条途径,开启合适的临床试验并控制研发费用,对于创新药公司是一条不错的开辟途径。
参考资料:
1-FDA官网
2-FDA《2023年新药治疗审批报告》
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..