Vertex Pharmaceuticals今日宣布,其和CRISPR Therapeutics联合开发的CRISPR/Cas9基因编辑疗法Casgevy(exagamglogene autotemcel,exa-cel)获美国FDA批准,用于治疗12岁及以上输血依赖性β地中海贫血(TDT)患者。这项批准较FDA预定的PDUFA日期提早了约一个半月。Casgevy在2023年12月获美国FDA批准上市,用于治疗12岁及以上镰刀型细胞贫血病(SCD)患者。
在Casgevy用以治疗TDT患者的全球临床试验中,试验达到主要终点,即患者至少连续12个月不需进行输血,显示Casgevy具有一次治疗,提供功能性治愈的潜力。此前公布的试验结果显示,在接受治疗的44名TDT患者中,42名在随访时间为1.2-37.2个月时,不再需要接受输血,剩余两名患者接受的输血水平分别降低75%和89%。
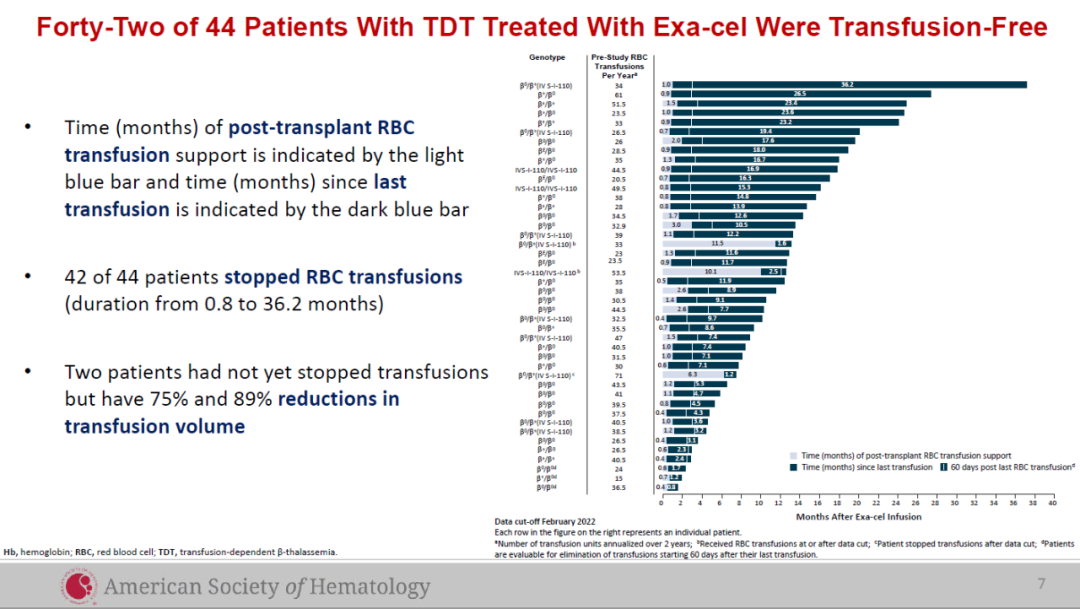
▲接受Casgevy治疗的TDT患者的临床试验数据(图片来源:CRISPR Therapeutics公司官网)
在这些正在进行的研究中,迄今为止接受Casgevy治疗的97例患者的安全性特征与白消安清髓性预处理和造血干细胞移植基本一致。
Casgevy是一款非病毒、自体细胞疗法,它利用CRISPR/Cas9基因编辑系统,在体外对来自患者的造血干细胞进行编辑,使血红细胞生产高水平的胎儿血红蛋白(HbF)。HbF是携带氧气的血红蛋白的一种形式,在出生时自然存在,随着婴儿的长大,血液中的血红蛋白转换为成人形式的血红蛋白。通过Casgevy治疗,可以提高HbF水平,有可能缓解输血依赖性β地中海贫血患者的输血需求,并减少镰刀型细胞贫血病患者的疼痛和使人衰弱的血管闭塞性危象。
2023年11月,Casgevy获英国药品和健康产品管理局(MHRA)有条件上市许可,用于治疗12岁及以上SCD与TDT患者,成为全世界首款获批上市的CRISPR基因编辑疗法。
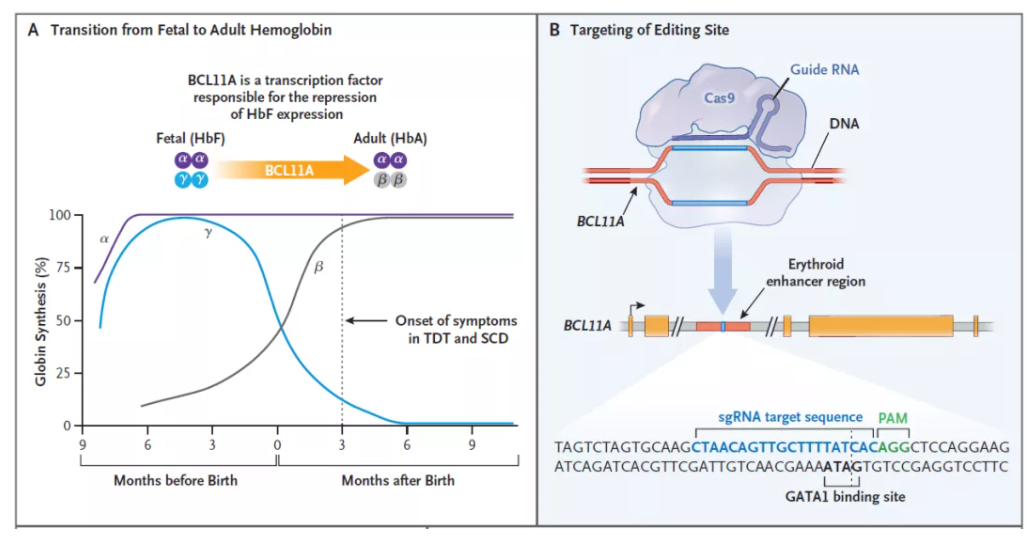
▲Casgevy的作用机制:A,BCL11A是下调胎儿血红蛋白表达的转录因子;B,Casgevy通过对BCL11A进行基因编辑,上调胎儿血红蛋白的表达
2015年,Vertex公司和CRISPR Therapeutics达成战略研究合作,专注于利用CRISPR/Cas9发现和开发针对人类疾病潜在遗传原因的潜在新治疗方法。根据修订后的合作协议,Vertex公司正领导Casgevy的全球开发、制造和商业化。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..