1 月 11 日,据 CDE 临床试验登记与信息公示平台显示,礼来口服 GLP-1R 激动剂 Orforglipron 国内启动新一项 III 期临床 ACHIEVE-5 试验(登记号:CTR20240093)。
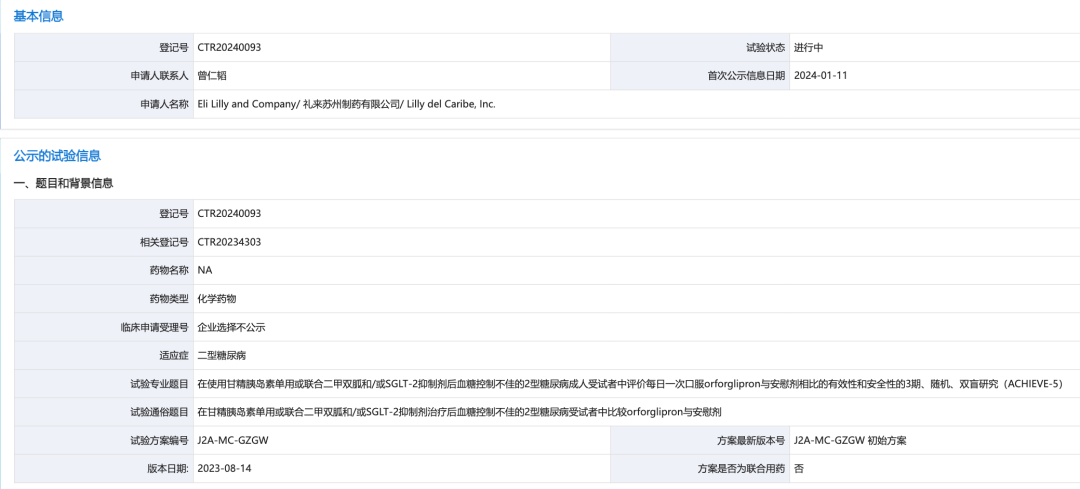
来自:CDE 官网
不过,此前礼来已在去年 10 月在 ClinicalTrials.gov 上登记了该研究(登记号:NCT06109311),本次启动的是国内部分。该研究旨在在使用甘精胰岛素单用或联合二甲双胍和/或 SGLT-2 抑制剂后血糖控制不佳的 2 型糖尿病成人受试者中,评价每日一次口服 Orforglipron 与安慰剂相比的有效性和安全性。
礼来的 Orforglipron(LY3502970)是全球首个启动 III 期临床的口服小分子 GLP-1RA,与曾经的替尔泊肽一样,属于赛道领头者。
在 2023 ADA 年会上,LY3502970 首次发布了 II 期临床数据,包括针对 2 型糖尿病的临床结果和针对肥胖症的临床结果。
肥胖症方面,经过 36 周 Orforglipron 治疗,45mg 剂量组减重 14.7%,相较安慰剂组减重 12.4%。糖尿病临床中同样有减重结果披露,Orforglipron 治疗 26 周时实现 10.1kg 减重,而安慰剂和度拉糖肽组则分别为 2.2kg 和 3.9kg。
Orforglipron 减重数据
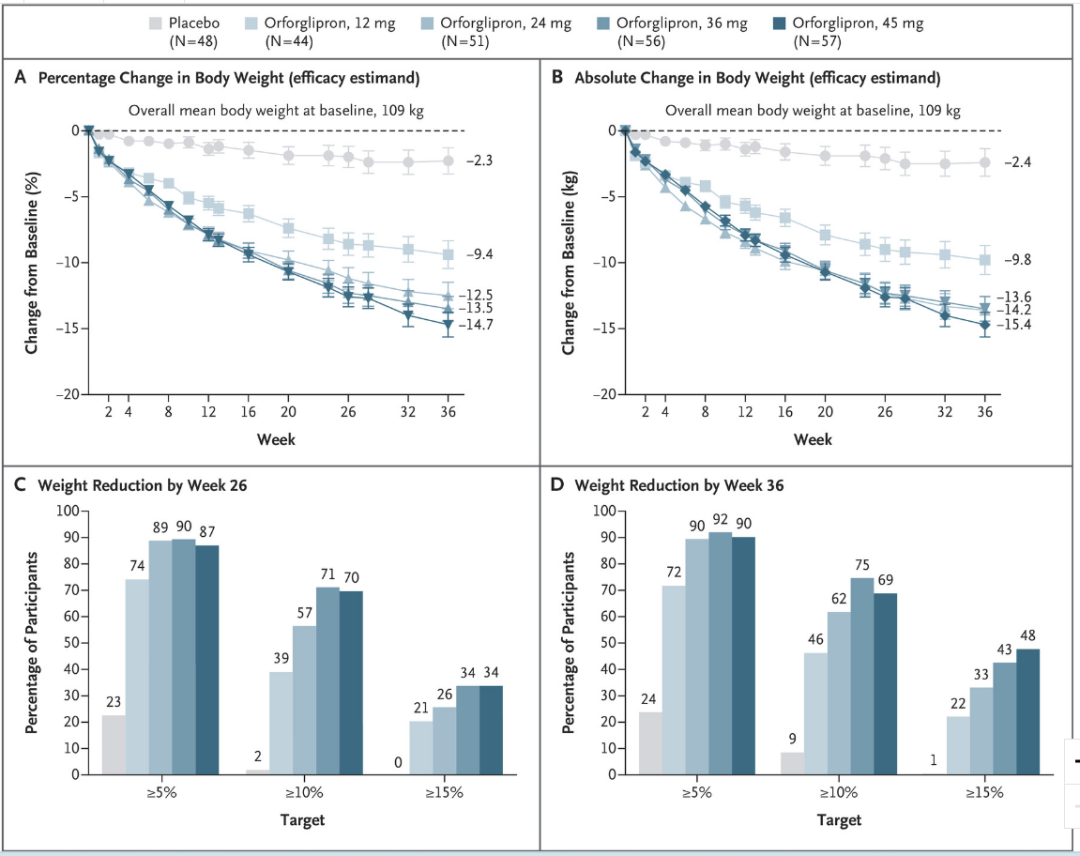
来自:Lancet
Orforglipron 当前针对肥胖、2 型糖尿病分别在国内启动了 5 项 III 期研究,全速推进中。其中,ATTAIN-1 试验(试验登记号:CTR20232459)是 Orforglipron 在国内启动的首个 III 期临床试验,针对肥胖或伴有体重并发症的超重。
Orforglipron 国内 III 期临床试验
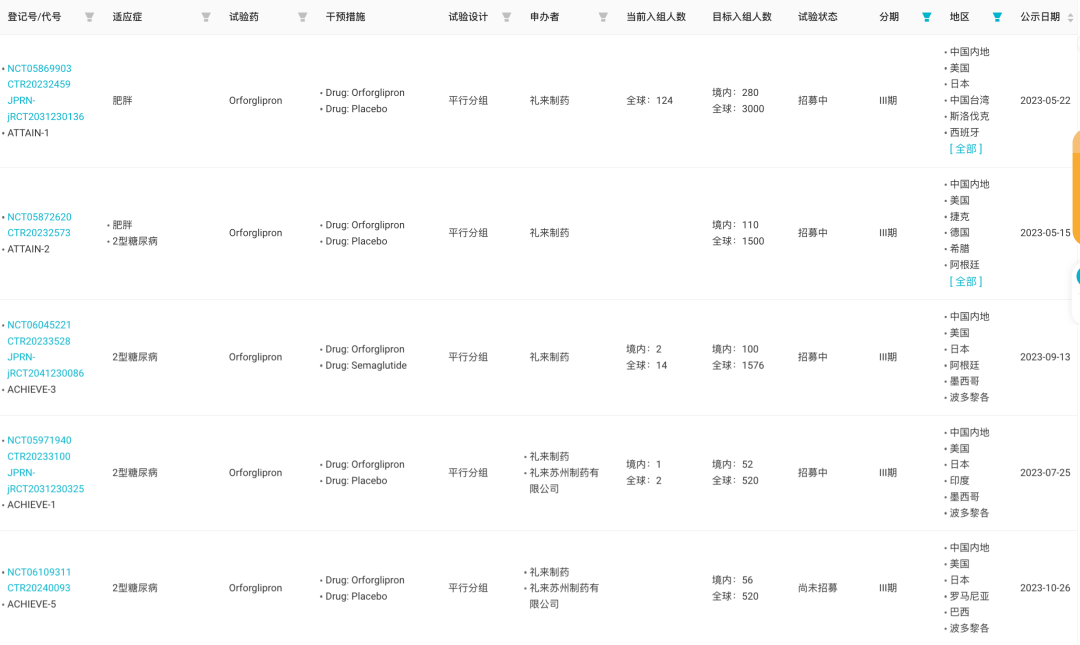
来自:Insight 数据库网页版
除口服小分子 Orforglipron 外,礼来布局的多款 GLP-1 产品在国内进展迅速,包括 GLP-1R/GIPR 双重激动剂替尔泊肽、GLP-1R/GIPR/GCGR 三重激动剂 Retatrutide 等。
替尔泊肽降糖以及减重两项适应症已在国内报上市,当前处于审评中。在国内已启动了针对2 型糖尿病、肥胖以及肥胖合并 OSA 等适应症 9 项 III 期临床试验。Retatrutide 为全球进度最快的 GLP-1R/GCGR/GIPR 三靶点激动剂。II 期临床试验结果显示,在治疗 48 周时,每周注射 12mg Retatrutide 治疗的受试者平均体重可减轻 24.2%。国内暂未启动 III 期临床,不过全球已启动 4 项 III 期临床。
GLP-1 是非胰岛素类降糖药开发的三大热门靶点之一,也是礼来的领先布局领域,目前礼来已开始大局进军国内 GLP-1 市场。在国内,据《2022 年药品市场生命周期研究之 GLP-1RA 篇》报告预测,2022 年到 2030 年,中国 GLP-1RA 市场规模将从 56 亿元增长至 158 亿,复合增速 14%。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..