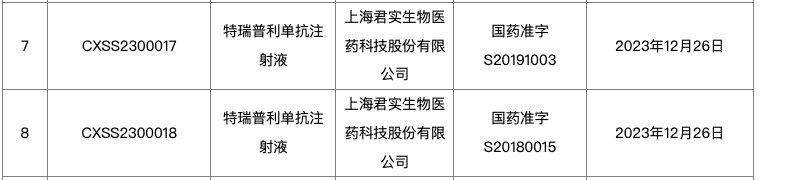
1 月 2 日,据 NMPA 官网显示,君实特瑞普利单抗新适应症获批上市,联合化疗围手术期治疗并单药作为辅助治疗后巩固治疗,用于可切除 III 期非小细胞肺癌的治疗(受理号:CXSS2300017)。
去年 4 月该适应症的上市申请获受理,成为首个递交围手术期适应症上市申请的国产 PD-(L)1,开创了国内 NSCLC 围手术期免疫治疗新模式,让免疫治疗贯穿了术前新辅助至术后辅助以及巩固维持的治疗全过程。

来自:NMPA 官网
本次新适应症的上市申请基于 Neotorch 研究(登记号:NCT04158440),这是一项随机、双盲、安慰剂对照、多中心的 III 期临床研究,由上海交通大学医学院附属胸科医院陆舜教授担任主要研究者。
2023 年 1 月,Neotorch 研究完成方案预设的期中分析,成为全球首个抗 PD-1 单抗用于 NSCLC 围手术期(涵盖新辅助和辅助治疗)治疗达到 EFS 阳性结果的 III 期临床研究。
Neotorch 研究共纳入 404 例 III 期 NSCLC 患者,以 1:1 的比例被随机分配至特瑞普利单抗联合化疗组(n = 202)或安慰剂联合化疗组(n = 202),分别接受特瑞普利单抗或安慰剂联合化疗术前 3 周期及术后 1 周期治疗(鳞癌患者化疗方案为紫杉类+铂类,非鳞癌患者化疗方案为培美曲塞+铂类),随后接受特瑞普利单抗或安慰剂巩固治疗 13 周期。
截至 2022 年 11 月 30 日(中位随访时间 18.25 个月),结果显示:
与单纯化疗相比,特瑞普利单抗联合化疗用于 III 期可手术 NSCLC 患者围手术期治疗并在后续进行特瑞普利单抗单药巩固治疗,可显著延长患者 EFS(研究者评估的中位 EFS 分别为尚未成熟 vs 15.1 个月,P<0.0001),疾病复发、进展或死亡风险降低达 60%(HR = 0.40,95%CI:0.277-0.565,双侧 P<0.0001)。两组的 1 年 EFS 率和 2 年 EFS 率分别为 84.4% vs 57.0% 和 64.7% vs 38.7%。
同时,经盲态独立中心病理(BIPR)评估,特瑞普利单抗联合化疗组的主要病理缓解(MPR)率和完全病理缓解(pCR)率方面均优于单纯化疗组,分别为 48.5% vs 8.4%(P<0.0001)和 24.8% vs 1.0%(P<0.0001)。特瑞普利单抗联合化疗组的总生存期(OS)也显示出明显的获益趋势。两组中位 OS 分别为未成熟 vs 30.4 个月(HR = 0.62,95% CI: 0.381-0.999);1 年 OS 率和 2 年 OS 率分别为 94.4% vs 89.6% 和 81.2% vs 74.3%。患者将继续进行 OS 随访。
值得注意的是,新辅助治疗后,相比安慰剂联合化疗组,特瑞普利单抗联合化疗组中有更高比例的患者接受了根治目的的手术(82.2% vs 73.3%),提示在化疗基础上联合特瑞普利单抗治疗为更多患者带来了根治性治疗的机会。
安全性方面,两组治疗期间出现的不良事件(TEAE)发生率相似,未观察到新的安全性信号。
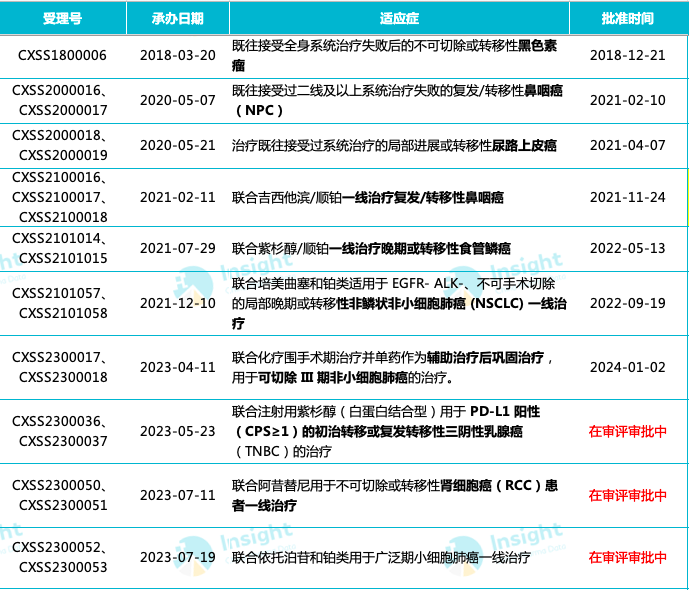
这是特瑞普利单抗获批上市的第 7 个适应症,此外,另有 3 项适应症处于上市申请阶段,当前仍在审评中。
来自:CDE 官网,Insight 整理
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..