日前,Arcutis Biotherapeutics宣布,美国FDA批准Zoryve(roflumilast,0.3%)外用泡沫剂的新药申请(NDA),用于治疗9岁及以上的脂溢性皮炎患者。Zoryve泡沫剂可快速清除脂溢性皮炎病灶并显著减轻患者瘙痒。Zoryve是一款每日一次的无类固醇泡沫剂。根据新闻稿,Zoryve是二十多年来首款获批用于脂溢性皮炎的新机制药物。
FDA的批准主要是根据临床2期试验(Trial 203)和关键3期试验STRATUM的积极结果。分析显示,STRATUM研究达到主要终点,近80%的接受Zoryve泡沫剂治疗患者在第8周时达到研究者整体评估(IGA)成功(Zoryve泡沫剂组:79.5% vs溶剂组:58.0%,P<0.0001)。在Trial 203试验中,73%的Zoryve泡沫剂治疗患者实现IGA成功(Zoryve泡沫剂组:73.1% vs溶剂组:40.8%,P<0.0001)。IGA成功定义为IGA评分为“清除”(0)或“几乎清除”(1),加上第8周时IGA评分较基线改善2级。
此外,试验中观察到Zoryve泡沫剂很早便改善患者症状,在第2周(STRATUM中评估疗效的第一个时间点),Zoryve与溶剂相比在统计上显著改善患者IGA成功率。此外,50.6%接受Zoryve泡沫剂治疗的患者在第8周达到完全清除(IGA=0)。
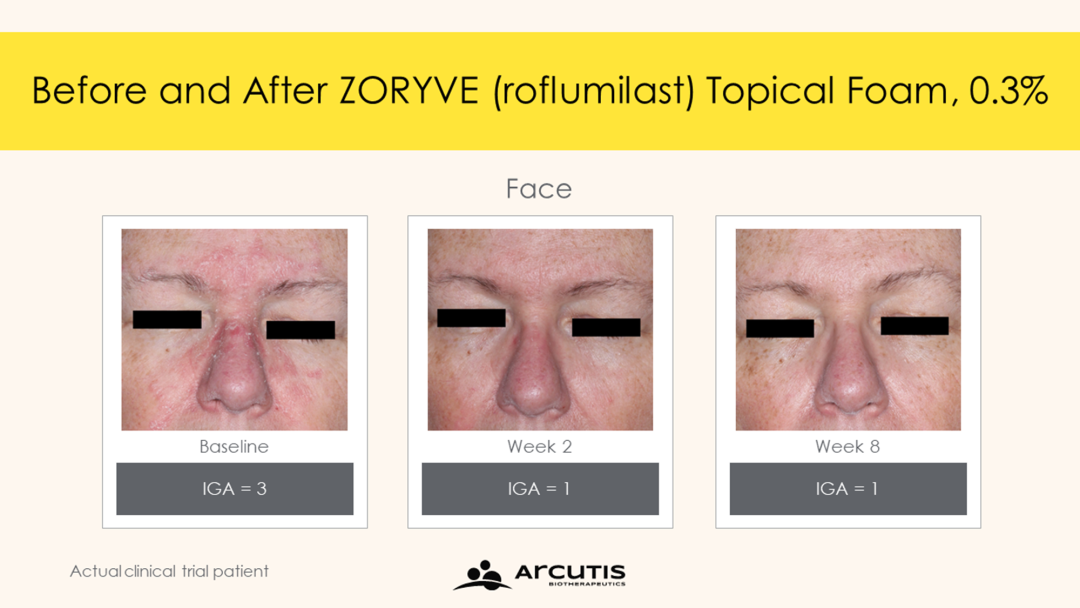
▲接受Zoryve泡沫剂治疗患者脸部症状获得改善(图片来源:参考资料[1])
安全性方面,在长达52周的治疗期间,Zoryve泡沫剂展现良好的安全性和耐受性特征。治疗后出现不良事件(TEAE)的发生率低,且药物组与溶剂组的TEAE比率相似,大多数TEAE的严重程度评估为轻度至中度。未发生治疗相关严重不良事件(SAE)。
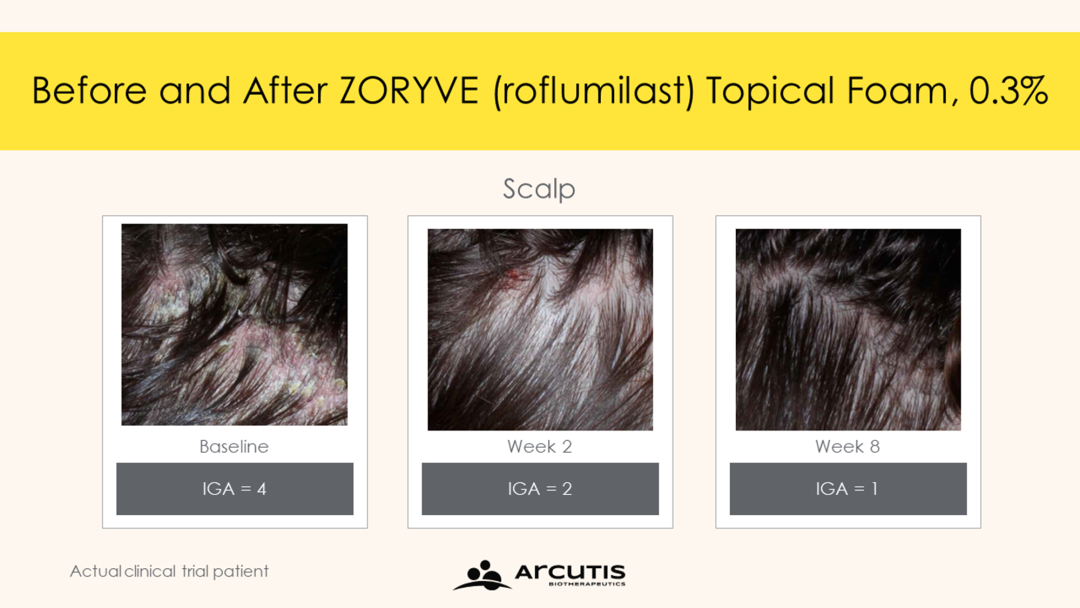
▲接受Zoryve泡沫剂治疗患者头皮症状获得改善(图片来源:参考资料[1])
Zoryve是一款每日一次、无类固醇疗法,属于下一代4型磷酸双酯酶(PDE4)抑制剂。PDE4是一种细胞内蛋白酶,可增加促炎介质的生成并减少抗炎介质的生成,与广泛的炎症性疾病有关。Zoryve当中的roflumilast成分作为口服疗法时显示出比其他两种FDA批准的PDE4抑制剂具更强的效力(25-300倍)。2022年7月,美国FDA批准Zoryve乳剂上市,用于治疗12岁以上斑块状银屑病患者,这是首款获得批准治疗斑块状银屑病的外用PDE4抑制剂。
参考资料:
[1] FDA Approves Arcutis’ ZORYVE® (roflumilast) Topical Foam, 0.3% for the Treatment of Seborrheic Dermatitis in Individuals Aged 9 Years and Older. Retrieved December 18, 2023 from https://www.arcutis.com/fda-approves-arcutis-zoryve-roflumilast-topical-foam-0-3-for-the-treatment-of-seborrheic-dermatitis-in-individuals-aged-9-years-and-older/
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..