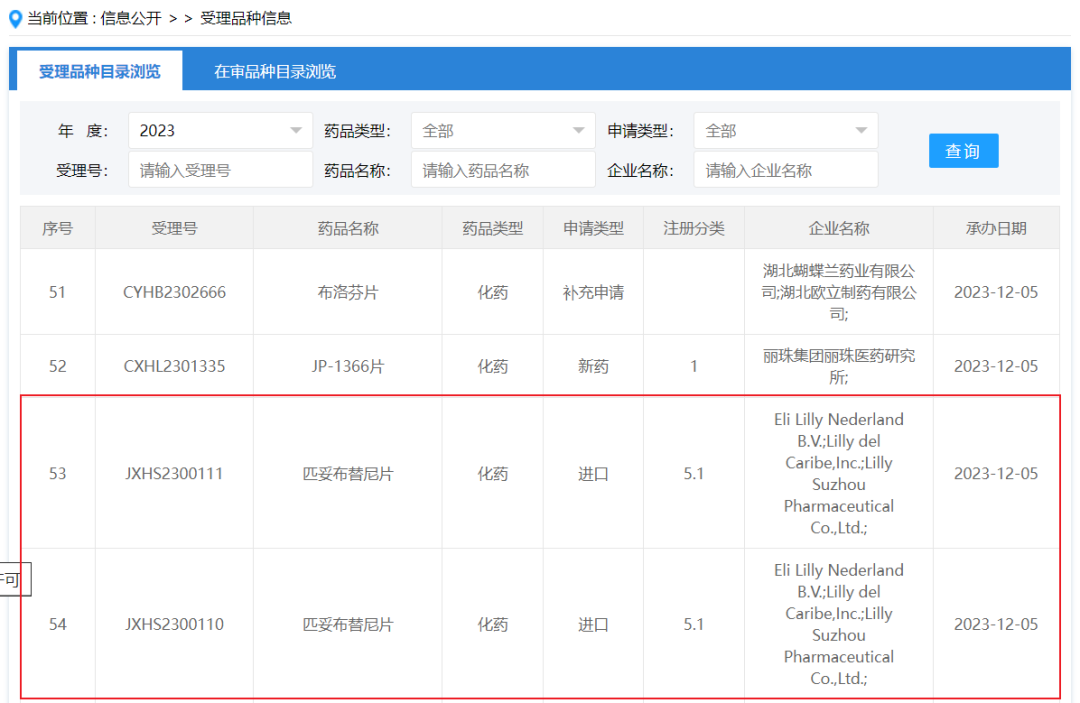
12月5日,CDE网站显示,礼来可逆BTK抑制剂匹妥布替尼(pirtobrutinib)在华申报上市,适应症为既往接受过BTK抑制剂治疗的复发或难治性套细胞淋巴瘤(MCL)成人患者。
Pirtobrutinib原是Redx Pharma开发的一款可口服的高选择性可逆BTK抑制剂,对野生型和C481S获得性耐药突变型BTK均有抑制效果。因此,Pirtobrutinib可以解决一代不可逆BTK抑制剂的耐药问题。
2017年7月,Loxo Oncology以4000万美元将当时尚处于临床前阶段的Pirtobrutinib收入囊中。后来,Loxo又被礼来以80亿美元并购,该产品便归入礼来研发管线。2022年3月,信达生物以4500万美元的首付款获得了Pirtobrutinib在中国的商业化权益的优先谈判权(以及雷莫西尤单抗和塞普替尼的独家商业化权益)。
今年1月,Pirtobrutinib凭借I/II期BRUIN研究的积极结果获FDA加速批准上市,用于治疗既往接受过至少二线系统治疗(包括BTK抑制剂)的复发或难治性MCL成人患者。该产品也成为了全球首款获FDA批准的可逆BTK抑制剂。
在BRUIN研究中,接受Pirtobrutinib(200mg,每日1次)治疗的120例MCL患者中有一半实现了客观缓解,其中15例为完全缓解。
近日,Pirtobrutinib再度凭借BRUIN研究中慢性淋巴细胞白血病或小淋巴细胞淋巴瘤(CLL/SLL)队列的结果获FDA加速批准扩大适应症。在108例接受Pirtobrutinib(200mg,每日1次)治疗的CLL/SLL患者中,有78例(72%)实现了客观缓解(全部为部分缓解)。
目前,礼来正在开展一项针对MCL人群的全球III期临床以及四项针对CLL/SLL人群的全球III期临床。
BRUIN-MCL-321研究(n=500):对比研究者选择的BTK抑制剂(伊布替尼/阿可替尼/泽布替尼)治疗既往至少接受过一种系统治疗且未接受过BTK抑制剂治疗的MCL患者的有效性和安全性。
BRUIN-CLL-313研究(n=250):对比苯达莫司汀联合利妥昔单抗治疗初治CLL/SLL患者的有效性和安全性。
BRUIN-CLL-314研究(n=650):对比伊布替尼治疗初治CLL/SLL患者的有效性和安全性。
BRUIN-CLL-321研究(n=250):对比艾德拉尼/苯达莫司汀联合利妥昔单抗治疗既往接受过BTK抑制剂治疗的CLL/SLL患者的有效性和安全性。
BRUIN-CLL-322研究(n=600):联合维奈克拉和利妥昔单抗对比维奈克拉联合利妥昔单抗治疗既往至少接受过一种系统治疗(包括或不包括BTK抑制剂)CLL/SLL患者的有效性和安全性。
BTK早已成为内卷赛道之一,全球已有6款BTK抑制剂获批上市,另有6款处于III期研究阶段。除Pirtobrutinib以外,已上市的BTK抑制剂均为一代BTK抑制剂,不可避免地存在C481S突变导致的获得性耐药问题,令其疗效大打折扣。
不过,获得性耐药的出现也为BTK抑制剂赛道的后来者创造了新的竞争机会,正如EGFR抑制剂赛道上演的“四代同堂”态势。在6款III期在研BTK抑制剂中便有2款为针对C481S突变的产品,分别为Fenebrutinib(罗氏)和Nemtabrutinib(默沙东)。耐药性问题不止,这场为克服耐药性而引发的市场竞争拉锯战便不会停息,未来仍会有更多的竞争者涌现。
在对结合可逆性的改造之外,BTK抑制剂的后来者还有一条突围道路可选——适应症差异化,将目标市场由血液瘤转向自身免疫性疾病。赛诺菲、诺华和罗氏3家的BTK抑制剂产品均是其中的代表。
赛诺菲手握两款剑指自免市场的BTK抑制剂:Rilzabrutinib和Tolebrutinib。前者首攻免疫性血小板减少症,后者突击多发性硬化症(MS)和重症肌无力。诺华手中的Remibrutinib近期已顺利完成两项III期研究,明年便会申报慢性自发性荨麻疹适应症,有望成为首款“破圈”的BTK抑制剂。罗氏的Fenebrutinib亦加入了攻克MS的BTK抑制剂队伍,虽进度稍落后于赛诺菲,但已率先开展了挑战MS领域畅销生物药奥瑞珠单抗的头对头研究。有些不幸的是,Fenebrutinib的III期临床于近日因肝损伤风险被FDA部分暂停。若能排除安全性的障碍,Fenebrutinib的竞争实力仍不可小觑。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..