11月8日,据国家药监局官网信息公示,合源生物递交的CAR-T产品纳基奥仑赛注射液(曾用名:赫基仑赛)的上市申请已获得批准,用于治疗成人复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL),这也是国内首款获批上市的用于治疗急淋白血病的CAR-T产品。
公开资料显示,白血病是常见的血液肿瘤之一,急性淋巴细胞白血病(ALL)约占所有白血病的15%,其中B淋巴细胞型-ALL(B-ALL)约占ALL的75%。成人B-ALL患者较儿童B-ALL患者整体生存更差。成人B-ALL初治后复发率高,约60%的患者最终会进展到r/r B-ALL。成人r/r B-ALL患者预后极差,严重危及生命,临床缺乏有效治疗手段。截止目前针对急性淋巴细胞白血病,全球范围内仅批准了两款CAR-T产品,一款是针对儿童与年轻成人患者的诺华的Kymriah,一款是用于成人急淋的吉利德的Tecartus。
纳基奥仑赛注射液(CNCT19细胞注射液,Inaticabtagene Autoleucel)是一款靶向CD19的CAR-T细胞治疗产品,拥有创新的CD19 scFv(HI19a)结构,其的上市申请是基于一项用于治疗成人复发或难治性B细胞型急性淋巴细胞白血病的单臂、开放、多中心关键性临床研究。该研究由中国医学科学院血液病医院(中国医学科学院血液学研究所)王建祥教授担任主要研究者,在中国10家临床中心开展。主要研究终点为经独立评审委员会(IRC)评估的纳基奥仑赛回输后3个月时的总体缓解率(ORR),包括完全缓解(CR)和血细胞不完全恢复的完全缓解(CRi)。次要研究终点包括3个月内总体缓解率(ORR)、微小残留病阴性率(MRD-)、缓解持续时间(DOR)、无复发生存期(RFS)和总生存期(OS)。
在去年12月举行的第64届美国血液学年会(ASH)上,研究人员披露的相关研究数据显示,截至2022年9月27日,在39例接受了纳基奥仑赛注射液回输的成人r/r B-ALL患者中,总体缓解率(ORR)达82.1%,中位随访9.3个月时,中位缓解持续时间(DOR)尚未达到;在3个月时仍缓解的患者中,1年时预计有80%患者在持续缓解中;无论是否后续接受造血干细胞移植,均能表现出持续缓解和长期生存获益。安全性方面,3级及以上细胞因子风暴(CRS)发生率为10.3%;3级及以上免疫效应细胞相关神经毒性综合征(ICANS)发生率为7.7%,无非预期靶向CD19 CAR-T治疗导致的不良事件发生。
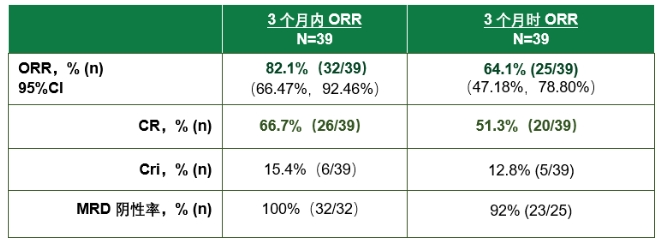
有效性数据总结 图片来源:合源生物
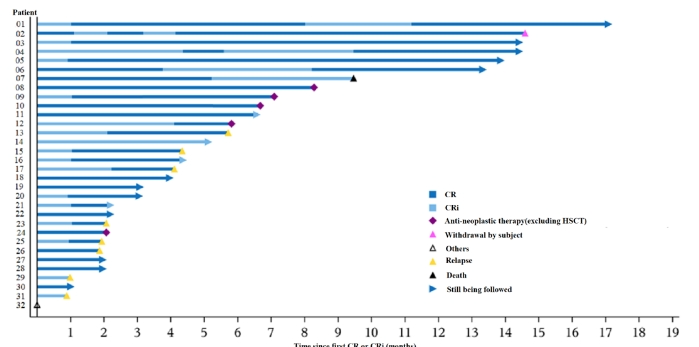
DOR泳池图 图片来源:合源生物
另据合源生物官网消息显示,纳基奥仑赛注射液的IND申请也已获美国FDA许可,拟开发用于治疗成人复发或难治性B细胞型急性淋巴细胞白血病(B-ALL)。
截至目前,国内已获批上市4款CAR-T产品,除了合源生物的纳基奥仑赛注射液,还包括复星凯特的阿基仑赛注射液(CD19)、药明巨诺的瑞基奥仑赛注射液(CD19)、驯鹿生物的伊基奥仑赛注射液(BCMA)。此外,国内还有两款靶向BCMA的CAR-T疗法向国家药监局提交了上市申请,即科济药业的泽沃基奥仑赛和传奇生物的西达基奥仑赛,二者均已被纳入优先审评。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..