美国 FDA 已将其知识辅助评价和结构化申请(Knowledge-aided Assessment and Structured Application,KASA)系统扩展至原料药审评,下一步将继续逐步扩展至研究用新药申请(IND)和新药申请(NDA)以改善药品申请的审评并加快产品上市速度。
FDA 药品审评与研究中心(CDER)药品质量办公室(OPQ)新药产品办公室处长 Hong Cai 于 10 月 31 日在 FDA 一年一度的药品质量研讨会上报告了 KASA 的当前进展及下一步计划。
KASA 目前已在固体口服制剂的简化新药申请(ANDA)中实施。Cai 表示,2023 年 3 月,FDA 已经完成了新药和仿制药的原料药 KASA 审评模版(KASA 4.0 和 4.2)。FDA 目前正在对商业 IND 第一阶段的 KASA 原型进行内测。2024 年,FDA 计划将仿制药 KASA 现有接口开发调整用于新药申请(NDA)生物药剂学和生产信息审评。Cai 还表示,未来计划将现有新药审评模版(例如,Orbis 计划)与 KASA 相协调,开发并测试用于新药审评的 KASA 系统。
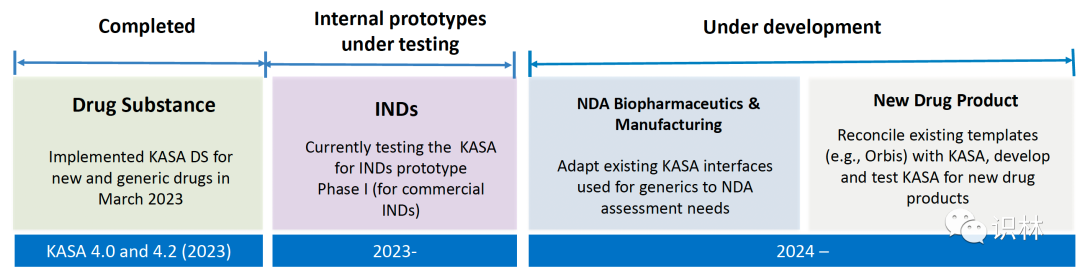
来自:Hong Cai 幻灯片
Cai 在其演讲中介绍了目前 FDA 在原料药审评 KASA 系统中增加了机器可读的化学结构 SD 文件,以快速识别潜在的高风险杂质,采用一致标准在评价 NDA、ANDA 和药物主文件(DMF)中的原料药信息,为决策提供信息并提高审评效率。
Cai 指出,在期望状态下,在 KASA 系统中,原料药的合成路线可搜索并且可分析,内置算法可以使 KASA 根据原料药、试剂、溶剂、杂质进行搜索并显示合成路线。目标是,识别可能产生高风险的化学反应/组合,并跟踪全球供应链,识别供应链薄弱环节。
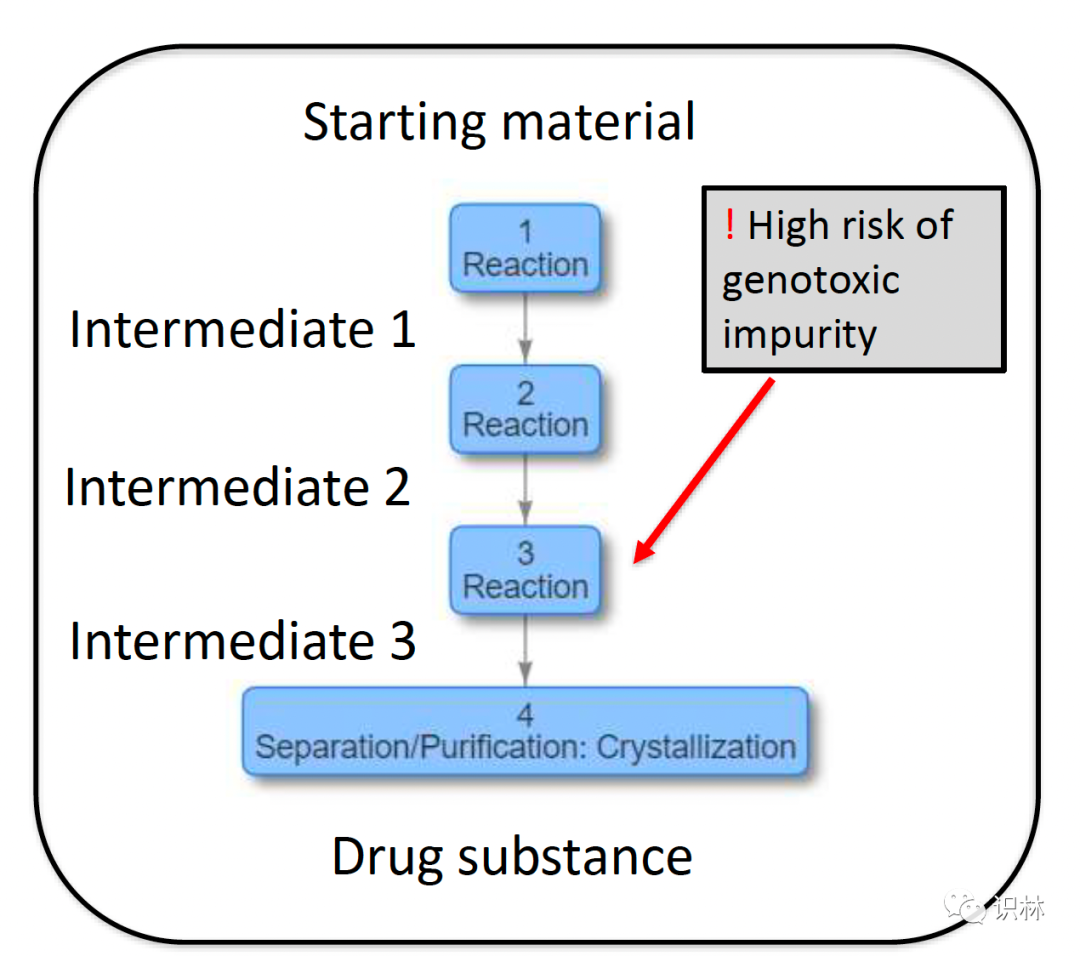
来自:Hong Cai 幻灯片
另外,Cai 还分享了 FDA 在设计用于 IND 审评的 KASA 时的一些考虑因素,包括:
CMC 变更对于 IND 来说很常见;
不同的 IND 可能共享相同的原料药(相同的 DMF);
相同的研究性药品可能在多个 IND 中进行研究;
具有不同的开发目标:除了营销目的外,还可能包括研究、扩大获取和治疗范围。
因此,用于 IND 的 KASA 需要具有灵活性、强化知识管理并能够促进创新。FDA 在开发 KASA IND 时采用了更加灵活的的模块化设计,主要包括三个模块:概要,原料药,研究性药品。在三个模块下又包括可灵活选择的不同的小模块。另外,根据 IND 的申报流程,在 KASA 上可自动在前序审评的基础之进行后续审评。审评人员可根据 IND 增补的内容选择需要重点关注的相关模块进行审评。
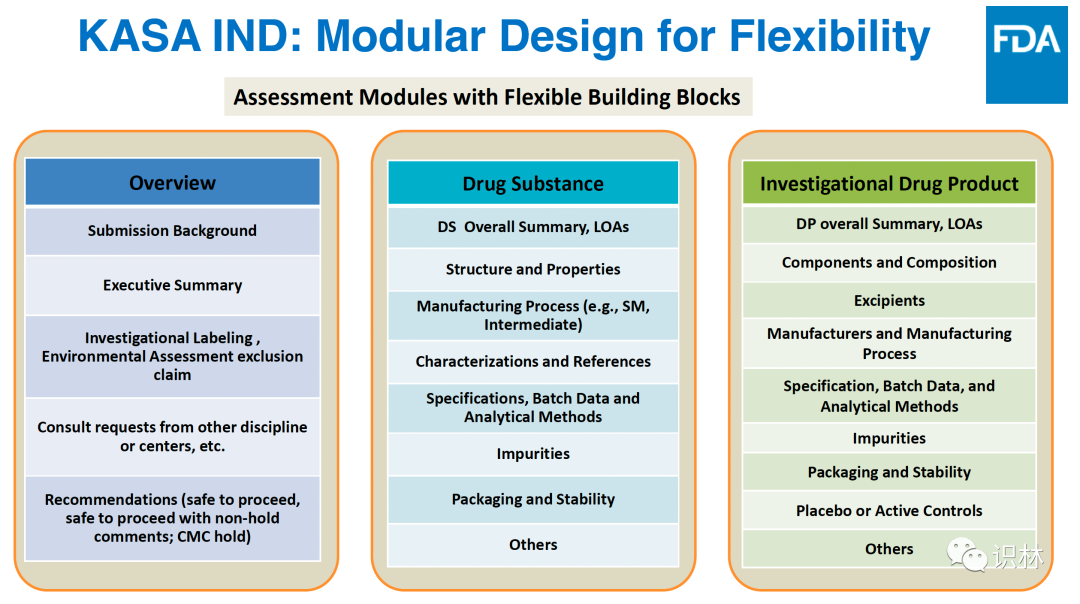
来自:Hong Cai 幻灯片
未来 KASA IND 系统还将通过具有共享 CMC 信息的授权书轻松管理和跟踪 IND,包括母 IND 和子 IND,并且能够轻松访问这些 IND 的先前质量评价。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..