Deciphera Pharmaceutical今天宣布其在研药品vimseltinib在治疗腱鞘巨细胞瘤(TGCT)患者的MOTION关键3期试验的积极顶线结果,这些患者不适合进行手术治疗。分析显示,该试验达主要终点,vimseltinib治疗组患者的客观缓解率(ORR)达统计学显著并具临床意义的改善。此外,该公司同时报告vimseltinib在临床1/2期试验的最新数据。Deciphera预计在2024年第二季度向美国FDA递交新药申请(NDA),并在2024年第三季度向欧盟递交上市许可申请(MAA)。
腱鞘巨细胞瘤是一种罕见的疾病,以关节和腱鞘滑膜组织增生为特征。患者由于特定的基因易位导致集落刺激因子-1(CSF-1)的过度表达和大量表达集落刺激因子-1受体(CSF1R)的巨噬细胞聚集形成肿瘤。尽管这种疾病很少转移,但它具有局部侵袭性和致残性。患者通常在20-50岁之间确诊。标准治疗是手术切除,但复发率很高。患者的生活质量通常受到肿瘤相关症状和手术后遗症的影响。
Vimseltinib是一款在研、强效、具高选择性的口服CSF1R激酶抑制剂。
MOTION关键性3期试验是一项两部分、随机双盲、安慰剂对照研究,旨在评估vimseltinib在既往未接受过抗CSF1/CSF1R治疗、无法进行手术的TGCT患者中的疗效和安全性。
分析显示,该研究在意向治疗(ITT)人群中达到主要终点,根据RECIST 1.1的盲法独立放射学审评(IRR)结果显示,在第25周时,与安慰剂相比,vimseltinib组患者具有统计学显著和临床意义的ORR改善。在ITT人群中,vimseltinib组在第25周时的ORR为40%(95% CI:29%-51%),安慰剂组为0%(95% CI:0%-9%),两组的缓解差异为40%(95% CI:29%-51%,p<0.0001)。
此外,研究还在第25周评估时达到所有关键次要终点,展现药物相对于安慰剂的统计学显著并具临床意义的改善,包括按肿瘤体积评分(TVS)、主动活动度(ROM)、身体功能、僵硬度、生活质量和疼痛。其中vimseltinib组在TVS上的ORR为67%,安慰剂组为0%(p<0.0001)。
Vimseltinib的耐受性良好,安全性特征与之前试验结果一致。
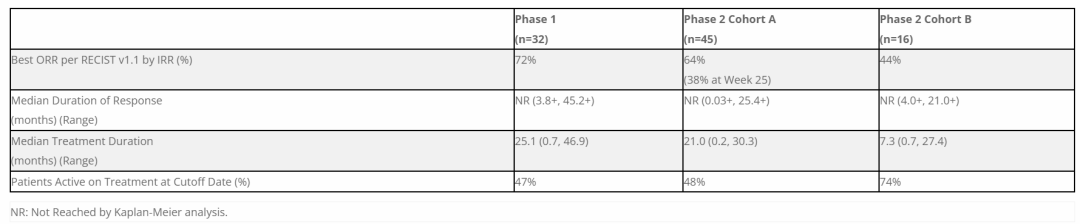
▲Vimseltinib临床1/2期试验结果摘要(图片来源:参考资料[1])
Deciphera同时报告vimseltinib的临床1/2期研究的数据。分析显示,在中位治疗持续时间为25.1个月(1期)和21.0个月(2期队列A)时,患者的最佳ORR为72%(1期)和64%(2期队列A)。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..