2023年10月2日,武田宣布,在经过了与FDA的讨论后,将与FDA合作,主动在美国撤回莫博赛替尼(EXKIVITY®,mobocertinib,中文商品名:安卫力)。

莫博赛替尼于2021年9月15日获FDA加速批准用于治疗含铂化疗期间或之后进展的、表皮生长因子受体(EGFR)20号外显子插入突变阳性(EGFR ex20ins)的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
此外,武田还决定在全球范围内发起相同的主动撤回,与目前可使用该药的国家的监管机构展开后续合作,其中可能也包含中国。
2023年1月,莫博赛替尼获NMPA批准在华上市,适应症同上,成为国内首个用于治疗该类患者的药物。
情理之中的撤市
武田对莫博赛替尼的撤市行为属于情理之中。
该产品获得FDA加速批准上市、获NMPA附条件批准上市基于的是EXKIVITY 1/2期单臂试验。
该试验共纳入114例既往接受铂类治疗的 EGFR ex20ins 突变NSCLC患者,取得了优秀的疗效数据。2021年ASCO上公布的数据显示,铂基化疗组(PPP)中位OS(总生存期)达到惊人的24个月。
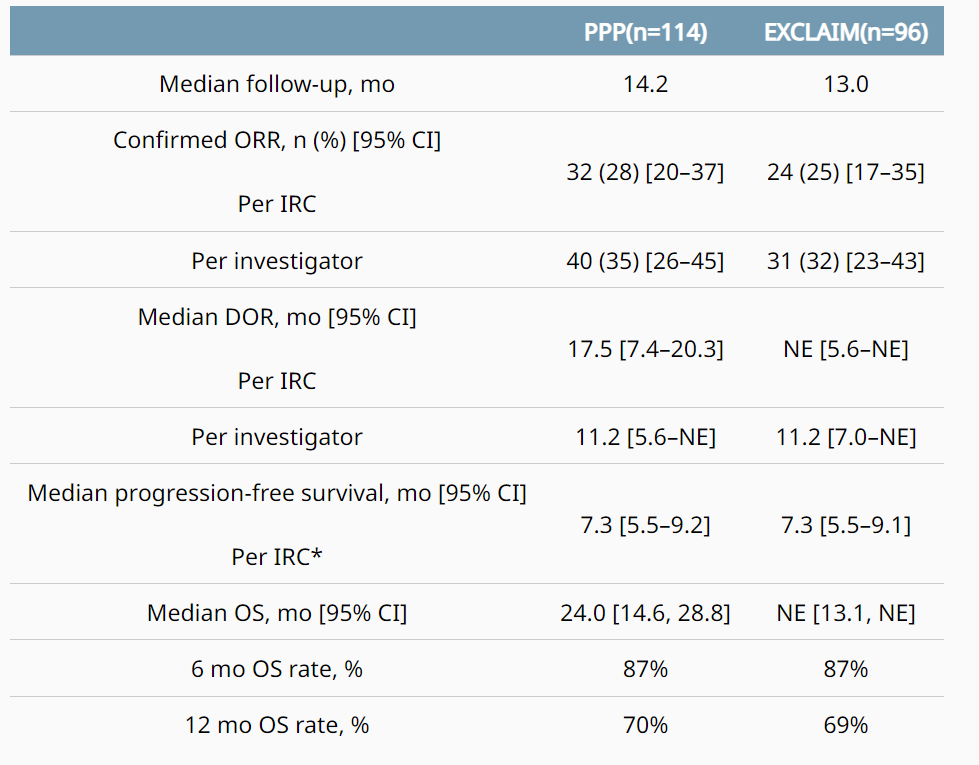
尽管取得了惊人的疗效,但单臂试验毕竟不够充分,还需要3期确证性试验Exclaim-2的验证。
2023年7月,武田公布2022财年的业绩报告,披露了莫博赛替尼的相关进展——缺乏疗效,试验终止。
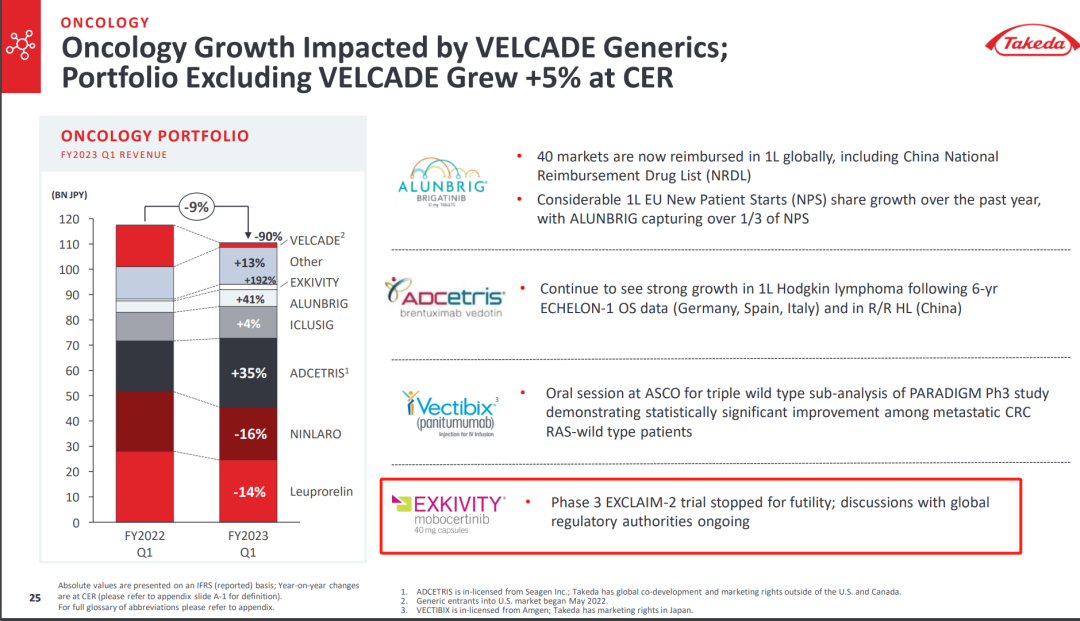
坦白来说,这并不算是个很诡异的结果。
因为在EXKIVITY 1/2的二线单臂试验成功后,武田直接让莫博赛替尼在Exclaim-2里作为一线单药疗法与化疗硬碰硬。回过头来看,即便是有强生的EGFR/c-MET双抗步步紧逼,这个操作略显激进。
总结
莫博赛替尼是否会在中国区撤市仍是未知之数,毕竟二线用药的临床数据依然扎实。
另外,虽然莫博赛替尼是国内首个相关疗法,但并非唯一一个。2023年8月,舒沃替尼也已或NMPA批准,用于二线治疗EGFR ex20ins突变NSCLC患者。
即便莫博赛替尼撤市,患者也不会无药可用。
对武田来说,这波打击最大的还是全球市场。作为潜在的增长动力,莫博赛替尼在美国撤市会对公司未来的增长计划产生巨大影响。
参考资料:
1.武田官网
2.clinicaltrials.gov
3.https://ascopubs.org/doi/abs/10.1200/JCO.2021.39.15_suppl.9014
4.其他公开资料
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..