近期,第九批集采要开始投标了,集采再次成为热门的话题。有的朋友经常问,集采品种怎么选项?
事实上,全国集采已经实施了八轮,规律已经非常清晰,选品无非是市场大、生产成本有优势、时间节点踩正确……
但如笔者此前写的文章所述,集采市场必然是逐渐压缩的,而院外市场则会不断扩大,是否有必要继续押注医院市场,跟大家一起卷,是更值得思考的问题。
一、越来越鸡肋的集采,是否有必要再卷下去
集采伊始,圈友们呼天抢地,但本人曾多次写文章,劝大家拥抱集采。现在回过头去看,在第一批和第二批集采中,率先通过一致性评价的企业占了大便宜。一方面,刚开始集采时,大品种较多,而中标企业较少,各自分到的市场比较大。但随着一致性评价的逐渐推进,通过集采的企业数量逐渐增多,单个产品分到的中标额也就越来越少了。
越来越卷的集采
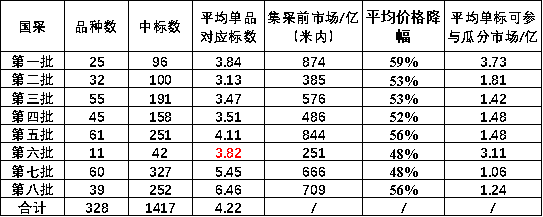
在第一轮集采中,25个品种一共产生了96个标,平均每个品种3.84个,而在第八批集采中,39个品种一共产生了252个标,平均每个品种是6.46个。
第一批集采的25个品种,集采前市场规模(2017年)为874亿元(米内公立医院放大版,下同),平均降价幅度为59%,降价后,平均每个标可参与瓜分(不等于分到)3.73亿元的市场。
而在第八轮集采中,集采前市场规模(2022年)为709亿元,平均降价幅度为56%,降价后,平均每个标仅可参与瓜分1.24亿元的市场。
另外从集采公布的平均理论中标额(中选省份报量*中标系数*中选价格,不考虑未公示规格的折算量)来看,第一批为0.48亿元,而第八批为0.17亿元,也呈现出明显的下降趋势。
其实,这种现象很好解释,集采是从大品种开始的,而且早期通过一致性评价的厂家少,分到的市场自然就大,随着集采和一致性评价的不断推进,大品种逐渐减少了,而通过一致性评价的厂家数却不断增多,僧多粥少的局面自然在所难免。
不仅如此,MAH制度实施以后,还出现了大量的B证企业,甚至上游无研发,下游无生产的基金、投资机构都加入了混战,不卷才怪!
虽然最近两轮集采中,几乎没有单价低于0.15元的低价药,但单次中标额太小,投资回报时间太长。
在第八批集采中,平均单次中标额仅为1700万元,如果考虑部分产品在公示中标规格外还有其它非主流规格(可以折算销量),而且医院在报量时有所保留,故假设实际供货量为报量的2倍,那么单次中标额也不过3400万元。
如果中标产品有30%的毛利,那么除去运营管理费用、税收后,净利润水平约为10%(高于欧美仿制药企业平均水平)。
也就是说,中标一个产品一年的净利润为340万,五年后的累计净利润为1700万。如果届时批文还能值500万,那么企业获得净收益是2200万。但按照行业平均水平,投资一个仿制药批文平均要1000万,开发时间为3年,外加上市销售5年,总共耗时8年,由此算得企业的投资回报率约为10%,成本回收期约为8年。如果产品不能连续两次中标,或毛利不足30%,那么投资大概率是亏损的。
当前通过一致性评价的批文还不算多,批文也比较值钱,但即便投入1000万获得一个批文,1200万卖了也是赔钱,因为承担了研发风险和时间成本。而且在批文交易过程中,还需要付诸大量的精力去配合转产。
不仅如此,随着一致性评价批文数量的增多、仿制药竞争加剧,批文也会逐渐贬值。跨国巨头打包甩卖美国的ANDA批文,平均下来才几十万美元一个而已,而且我国的CRO服务费、BE费用都在不断下降,仿制药批文的开发成本也在逐步回落。
随着集采的不断推进,大品种越来越少,竞争却越来越激烈,仿制药的投资回报率越来越低,成本回收时间越来越长,仿制药企业是否要继续拼命卷集采,是值得深思的问题。
二、集采是否会是仿制药降价的终点?
如果稍微了解国际仿制药市场,你的心中自然就会浮现出否定的答案。虽然集采的降价潮来势汹汹,但是相比美国,我国的仿制药竞争依然处于不充分的状态,仿制药价格依然处于全球较高的水平,IQVIA数据显示,我国仿制药平均价格为0.249美元(2022年,仿制药总销售额/仿制药总销量,仅包含AL数据库界定为仿制药的产品),在全球排名第六。
全球仿制药平均价格排名
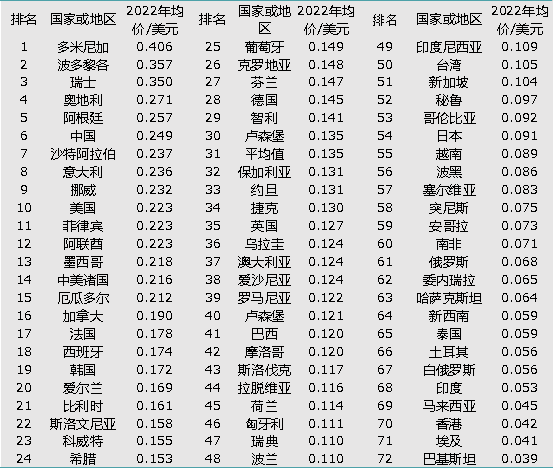
数据来源:IQVIA analytical link,以上数据仅包含被数据库界定为仿制药的产品,是总销售额÷总销量的结果,不区分剂型、规格和厂家。
或许这些话,同仁们并不爱听,但事实并不乐观,因为种种迹象都表明,国家控费的意愿非常强烈。
首先,我国老龄化形势越来越严峻,这不仅意味着更多的治疗需求,也意味着更重的社会负担,医保花钱的地方越来越多,收钱却越来越难,必然会导致严格的控费。
其次,国家提出“健康中国2030战略”,全面提升国民医疗健康水平,这需要投入大量的资源,同时也将会释放大量的新治疗需求,尤其是广大农村、偏远地区医疗升级。然而医保结存率在不断下降,有专家预测,医保自己有可能在10年内出现亏空。
再次,全球经济周期性转冷,我国的经济增长速度也出现了明显的减速,国家预算压力较大;最后,即便经过了多轮集采,我国的仿制药价格仍处于世界较高的水平,在集采之后,出现新的措施控制药价也不无可能。
在高强度控费之下,国家不仅要求仿制有更高的质量,而且要求有更低的价格(没有最低)。在集采之后,国家在大力推进DRG,其核心是让医生为病人的治疗预算负责,限制开高价药处方,虽然大部分仿制药在集采之后价格已经不算高价药,但依然可以逐步压缩。
除了实施DRG,某些发达国家为了实现控费要求,强制要求仿制药年度降价,如日本、法国。日本通过每年一次的价格目录修订,迫使企业下调批发价,而法国则通过社会保障融资法案 (LFSS)要求仿制药实行年度降价。在日本,首仿药上市时的定价就要求不超过原研的40%-50%,而法国为40%,再通过几年的强制降价,药价就会降得很低。
在这种不断降价的大背景之下,企业只有不断优化工艺,提升运营效率才能获得利润。这对有研发和生产的制药企业而言,会相对有利,而对于无研发和生产的B证公司而言,可能会较为被动。
其中的逻辑,很多人已经看清楚——仿制药到最后就是挣原料和制剂加工费而已,研发不在自己手上,如何去改进工艺降低成本?而生产不在自己手上,仅有一点加工环节的微薄利润也被别人赚走了,不赔钱就是好事了。
就当下而言,仿制药还没有卷到极限,而且很多B证公司因为比较灵活,响应比药企更快,所以占到一些先机。但这种优势想要保持,从长远来讲,还是必须自主拥有研发、生产、并且控制原料。
事实上,西方创新药CDMO或CMO较为常见,但仿制药并不多(占比不高),根本原因还是那句话,仿制药最终仅是赚生产环节的利润,但生产的利润都被别人赚走了,你还有啥?
三、Top 500品种集采结束后,还会进一步扩大品种规模吗?
时至今日,很多企业已经把抓集采仿制药作为一种产品战略,尤其是实施成本领先型战略的企业,当然也包括那些B证公司。但500个品种集采结束后,是否还会有新的品种纳入清单,的确是值得深思的问题。因为对这些企业而言,潜在的战略风险必须实时关注,而且一旦出现风吹草动,就必须进行快速地战略调整。
或许,在500个产品完事后,国采可能会告一段落(猜测而已)。原因如下:
第一,通过前8轮的集采,已经影响到约5000亿的市场(米内公立医院放大版),每年可节省上千亿的资金,几乎已经实现了费用控制和腾笼换鸟的目的,况且前仅完成了320多个品种的招采,剩余的170多个产品可以进一步查缺补漏。
第二,销售额前500个品种,几乎占据了80%以上的仿制药市场,剩余的产品市场较小,对国家、对企业而言都非常鸡肋,对那些小品种一一不仅工作量巨大,而且收益很小。
第三,有朋友认为,在国际经济环境不景气的形势下,政府需要给行业一些“回血”的时间,否则不利于行业的长远发展。
第四,集采这种制度决定了仿制药无法实现充分的竞争。因为企业一旦中标,2-3年内再无竞争,而且会对行业造成产能失调和资源浪费。例如,A企业的X产品中标,其可能为了满足X产品的供应而放弃其他产品的生产,甚至还需要扩产。而扩产后,如果X产品在第二轮集采中没有中标,该企业的新建产能就会造成资源浪费,而且原有的产品因多年不生产而无法复产。而B企业,可能因为X产品没有中标而批文白开发了……
对于小国而言(如欧洲),集采是降低仿制药价格的最好方式,因为市场小,竞争对手也少,无法形成充分的竞争。而对于大国而言,市场大,竞争对手也多,自由竞争反而能使药价降得更加彻底,如美国。如果我国形成一种良性的自由竞争机制,或许药价水平在集采的基础上还会进一步下降,同时行业资源也能够实现自然的优胜劣汰。
当然了,猜想总归猜想,但愿只是一厢情愿而已。
总结
本文是笔者的一篇随笔,记录的是笔者的所想与所思,内容不一定全部都正确,也并非是危言耸听或哗众取宠,在此更是希望让大家做最坏的打算,尽最大的努力争,取最好的结果。
医学上有种疗法叫冲击疗法,即通过直接使病人处于他所恐惧的情境之中,以收物极必反之效,从而消除恐惧。如果没有了恐惧,一切都是坦然,而自有真正坦然,才能沉着冷静地面对一切困难。
事实上,除了卷集采,仿制药也有很多出路可走。比如深耕院外市场,与OTC结合,玩品牌仿制药战略,也可以走差异化战略,通过技术平台仿创双驱,布局高壁垒仿制药和改良型新药,形成混搭的专科药管线。最后,也可以跳出这个拥挤的鱼缸,去积极开拓海外市场。
对于走高壁垒仿制药路线的企业,国内外市场协同是最佳的方案。因为很多高壁垒仿制药国内没有销量(原研没进来、此前无企业能仿制,医生也不知道咋用),市场定位较为困难。如果自行做市场推广,市场刚见起色可能就会出现一堆仿制药,最后又是集采,结局不过是免费给别人做嫁衣。
当然了,技术壁垒特别高(其他无人能仿制)或是渠道制胜的院外产品,情况可能会好很多。如果面临这种窘境,国内外市场协同是最好的措施。一般高壁垒仿制药在美国有巨大的销量,上市后可以直接替换原研市场,可以快速回笼资金。
而对于一般仿制药而言,只有在尽量多的国家注册,才能换得更多的经济价值。在一致性评价以后,我国药品标准已与国际接轨,符合国内水准的技术包也能达到大部分国家的要求,说不准在国内卖不动的产品,在哪个国家就把市场做大了呢……
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..