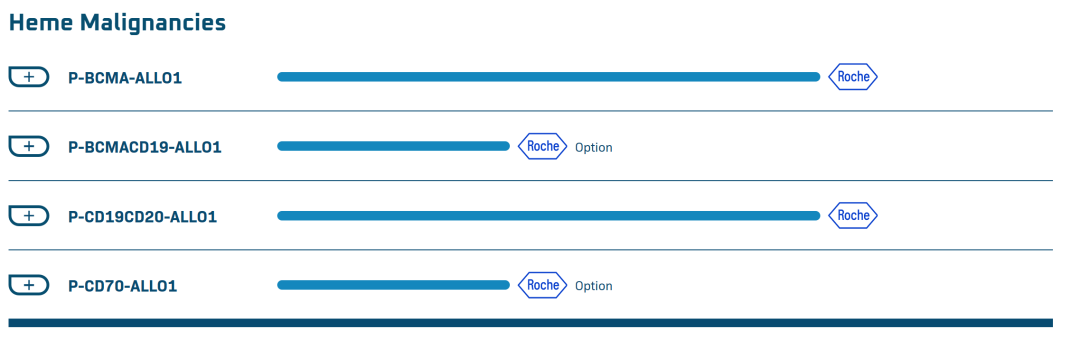
7月5日,细胞和基因治疗公司Poseida Therapeutics, Inc.(纳斯达克:PSTX)宣布,FDA已批准其 P-CD19CD20-ALLO1 的试验性新药(IND)申请。该药物靶向CD19和CD20抗原,用于治疗复发或难治性B细胞恶性肿瘤。
这是FDA首次批准针对CD19和CD20的同种异体双CAR-T疗法,也是该公司首款同种异体双CAR-T细胞候选产品。该药物目前正在与罗氏合作开发。

Kristin Yarema博士
Poseida 总裁 Kristin Yarema博士表示,我们很高兴P-CD19CD20-ALLO1获得IND批准,这是我们的第三个完全同种异体CAR-T细胞候选产品,也是我们与罗氏合作的第二个用于治疗血液恶性肿瘤的进入临床的疗法。双靶向方法利用了我们专有的非病毒piggyBac DNA递送系统,该系统能够将两种功能完全的CAR分子表达到来自健康供者的T细胞中,用于治疗可能具有异质性抗原表达的B细胞恶性肿瘤。我们认为,同时靶向CD19和CD20有可能克服目前可用的CD19导向的CAR-T产品的局限性,在这些局限性中,抗原逃逸已被观察到是重要的耐药机制。据估计,多达40%的B细胞恶性肿瘤复发或对靶向CD19的自体CAR-T疗法难治性的病例可能涉及抗原逃逸。

P-CD19CD20-ALLO1将在一项1期多中心、开放标签、剂量递增研究中进行评估,该研究将纳入多达70例复发性或难治性B细胞恶性肿瘤成人患者。本研究将评估P-CD19CD20-ALLO1的安全性、耐受性和初步疗效。纳入研究后,患者将接受基于化疗的淋巴细胞清除方案,然后给予P-CD19CD20-ALLO1同种异体CAR-T细胞。随着P-CD19CD20-ALLO1 IND获得批准,该公司正积极致力于开设临床研究中心。
关于Poseida Therapeutics
Poseida Therapeutics是一家临床阶段的生物制药公司,致力于分化细胞和基因疗法,以治愈某些癌症和罕见疾病。该公司的产品线包括用于固体和液体肿瘤的同种异体CAR-T细胞治疗候选产品,以及用于满足医疗需求高的患者群体的体内基因治疗候选产品。
公司在研管线

关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..