近日,国家药监局发出公告,经该局组织论证和审核,地氯雷他定分散片、氯雷他定颗粒、盐酸氨溴索口腔崩解片、萘普生钠片由处方药转换为非处方药。品种名单及其非处方药说明书范本一并发布。
国家药监局要求相关药品上市许可持有人在2024年1月22日前,依据《药品注册管理办法》等有关规定,向省级药品监督管理部门提交修订说明书备案,并将说明书修订内容及时通知相关医疗机构、药品经营企业等单位。
非处方药说明书范本规定内容之外的说明书其他内容按原批准证明文件执行。药品标签涉及相关内容的,应当一并修订。药品上市许可持有人提交备案之日起生产的药品,不得继续使用原药品说明书。
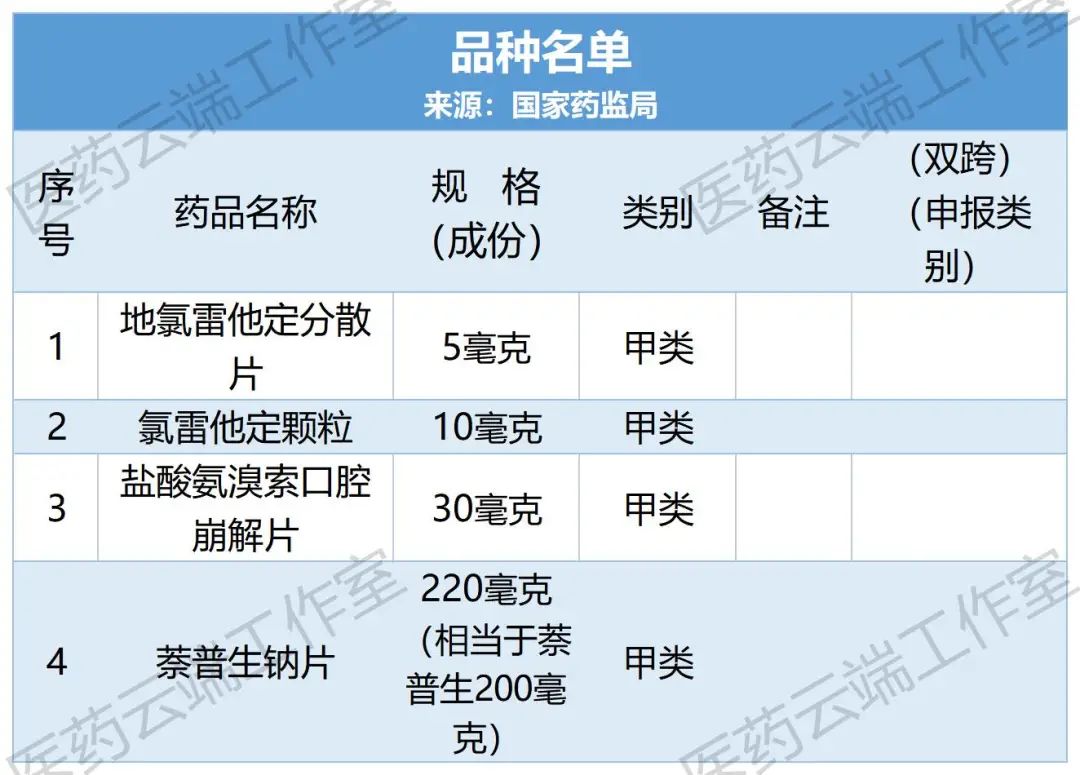
处方药、非处方药(OTC)与双跨品种
按我国药品管理法及相关法规,药品分为处方药及非处方药(OTC,over the counter),从严格意义上讲,某种药物被批准为非处方药,只是获得了非处方药的身份,经法规许可放宽其出售和使用的自由度。
事实上,许多药物既有处方药身份,又有非处方药身份(即双跨品种)。非处方药制定实施后,每隔3~5年进行一次再评价,推陈出新,优胜劣汰,确保OTC的有效性和安全性。
一种药品作为处方药或非处方药的身份并非一成不变,符合一定条件,处方药可以转为非处方药,并且有时候一种药物既可以是处方药也可以是非处方药(即双跨品种)。
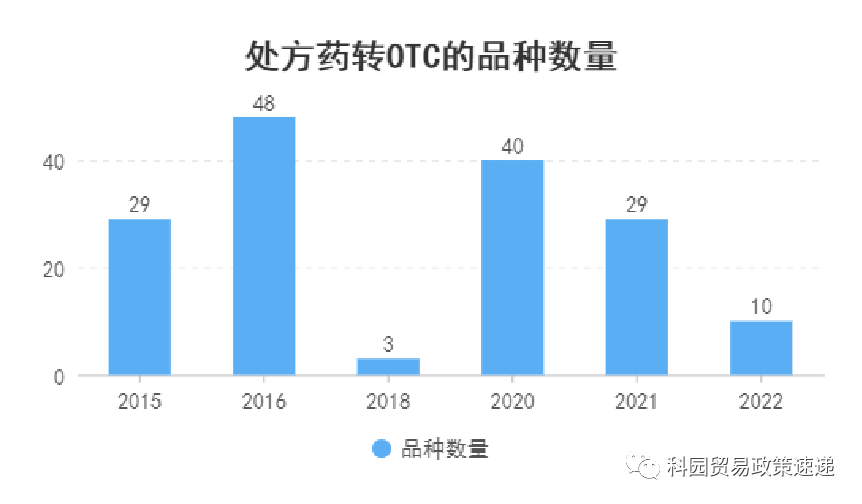
近年来“处转非”的品种数量
据《科园贸易政策速递》统计,在我国目前各类药物中,OTC约为4800个,其中中成药3704个,化学药1000余种;甲类(含双跨)品种约3500个,乙类(含双跨)品种。中成药在“处转非”的品种数量中占绝对优势,约75%为中成药,其余为化学药品。
“出转非”的申请要求
2022年10月,国家药监局药品评价中心(以下简称评价中心)发布《处方药转换非处方药申请资料及要求》(以下简称《要求》)。自2022年11月1日起,处方药转换非处方药申请按《要求》提交资料。
《要求》分为总体要求、化学药品与生物制品、中成药三部分。《要求》明确,申请人应参照处方药转换为非处方药评价指导原则,结合产品情况开展非处方药适宜性自评,并在提交资料中详述自评结论和理由;申请资料要求进行文献检索的,检索范围应当包括国内外主要医药学文献;全部申请资料应当提供纸质文件和电子文档;申请人需对申请资料的真实性负责。

四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..