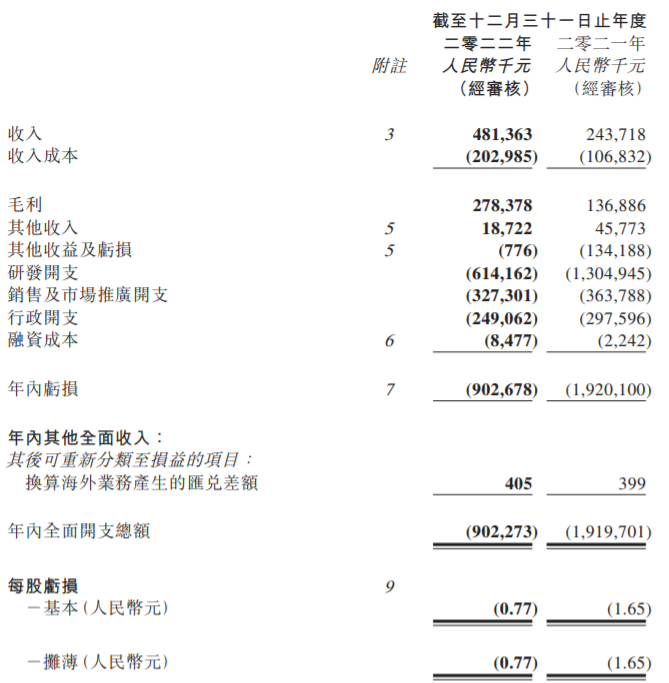
3月15日,基石药业公布2022年年度业绩及近期项目进展情况。2022年,基石药业总收入为4.814亿人民币,其中商业化收入3.941亿人民币,同比增长142%。
截至2022年12月31日,基石药业现金储备为10.42亿人民币,年内亏损为9.027亿人民币,较2021年同期的19.201亿人民币减少10.174亿人民币,主要是收入增加及研发开支减少。研发投入为6.142亿人民币,较截至2021年减少6.907亿人民币。
2022年,基石药业成功实现了艾伏尼布(拓舒沃)的商业上市,迎来了舒格利单抗(择捷美)和普拉替尼(普吉华)新适应症获批。
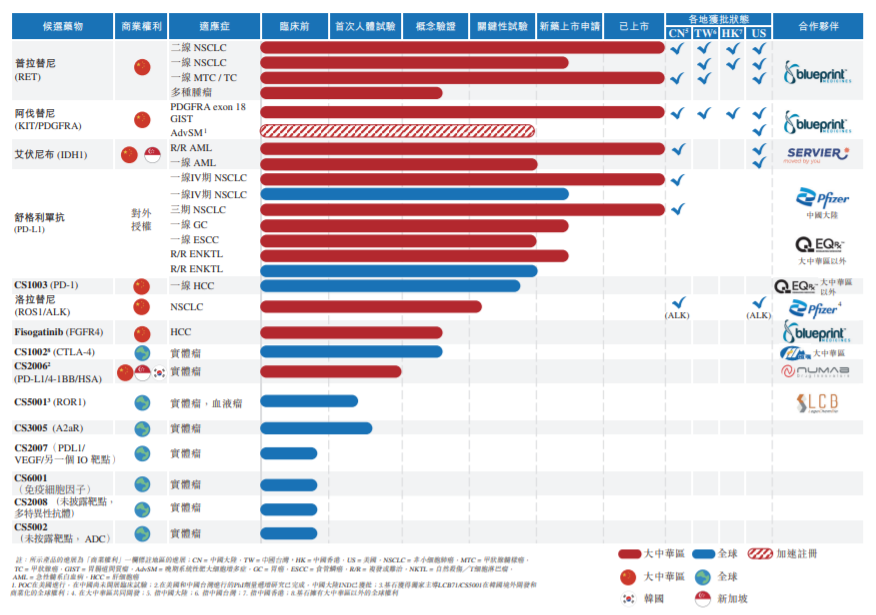
此外,2022年基石药业还提交了另外5项NDA,正在审评中:普拉替尼在中国大陆一线治疗RET融合阳性NSCLC;舒格利单抗在中国大陆用于复发或难治性结外自然杀伤细胞/T细胞淋巴瘤(R/R ENKTL);舒格利单抗在英国一线治疗IV期NSCLC;舒格利单抗在欧盟一线治疗IV期NSCLC;舒格利单抗在中国大陆一线治疗胃腺癌/胃食管结合部腺癌(GC/GEJ)。
展望2023年,基石药业预期的NDA批准包括:
普拉替尼:2023年上半年在中国大陆批准其用于一线治疗局部晚期或转移性RET融合阳性NSCLC的NDA。
阿伐替尼:在美国有关治疗成人惰性系统性肥大细胞增多症的处方药使用者付费法案(PDUFA)决议日期为2023年5月。
艾伏尼布:2023年在欧盟获批用于一线治疗AML及IDH1突变局部晚期或转移性胆管癌的MAA。
洛拉替尼:2023年完成ROS1阳性晚期NSCLC注册性试验患者入组。
舒格利单抗:2023年下半年在中国大陆批准R/R ENKTL的NDA。
舒格利单抗:2023年下半年或2024年上半年在英国批准用于一线治疗IV期NSCLC的MAA。
舒格利单抗:于2023年下半年或2024年上半年在中国大陆批准用于一线治疗GC/GEJ的NDA。
临床研究方面,基石药业将在2023年公布CS5001 (ROR1 ADC)早期转化数据,并在第一季度完成中国首例患者入组,预计将在年底前公布初步临床数据。继续开展CS2006(4-1BB/PDL1/albumin三特异性抗体)单药剂量的概念验证扩展研究,以及完成洛拉替尼ROS1阳性晚期NSCLC注册性试验患者入组。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..