近年来,随着对罕见病研究(如临床前模型、遗传学、病理学、生物标志物、成像和临床研究等)日益深入和诸如基因疗法等新技术的广泛应用,罕见病领域正在经历翻天覆地的改变。
FDA批准新药连续3年超50%
业界长期以来一直将世界罕见病的平均数量定为7000种,或者估计在5000到8000之间。
然而,近20年来随着生命科学行业对罕见病研究的深入,每年有近300种新的罕见遗传疾病被发现。因此,非营利组织Rare-X基金会于2022年发布的一项分析报告称,目前全球罕见病有多达10867种,而且这一数字还在持续快速增长。
对罕见病的研究迅速促进罕见病药物(孤儿药)开发浪潮的到来。
据美国药品研究与制造企业协会(PhRMA)此前发布的报告,目前生物制药行业正在开发的(临床试验阶段或等待FDA审查)罕见病药物有近800种。其中168种罕见癌症和120种罕见血液癌症药物,合计占36%(分别为21%和15%),罕见遗传疾病药物也达到192种,占比24%。
生物制药企业的研发热情正在把越来越多的罕见病药物推向市场。据笔者统计,近10年(2013年-2022年)来,美国食品药品管理局(FDA)药物评价与研究中心(CDER)共批准的428款新药中,罕见病药物数量为207款,占比达到了48%。而且,近年来FDA批准罕见病药物比例呈现持续增长趋势,FDA连续3年来批准罕见病药物比例超过50%。
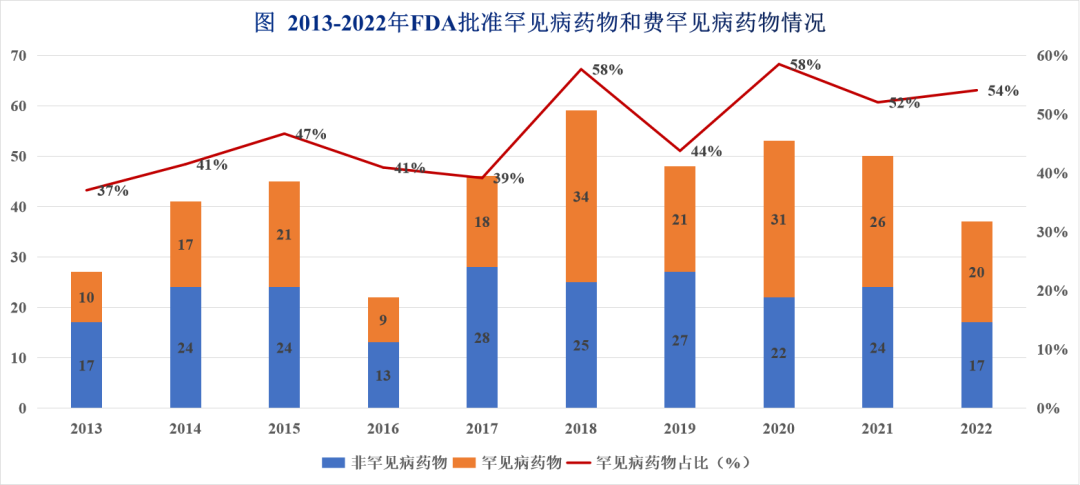
展望未来,罕见病药物仍将是生物制药行业快速增长的细分领域。据GlobalData预测,2023年FDA将做出至少35项罕见病药物监管决定。
开年新批药物高歌猛进
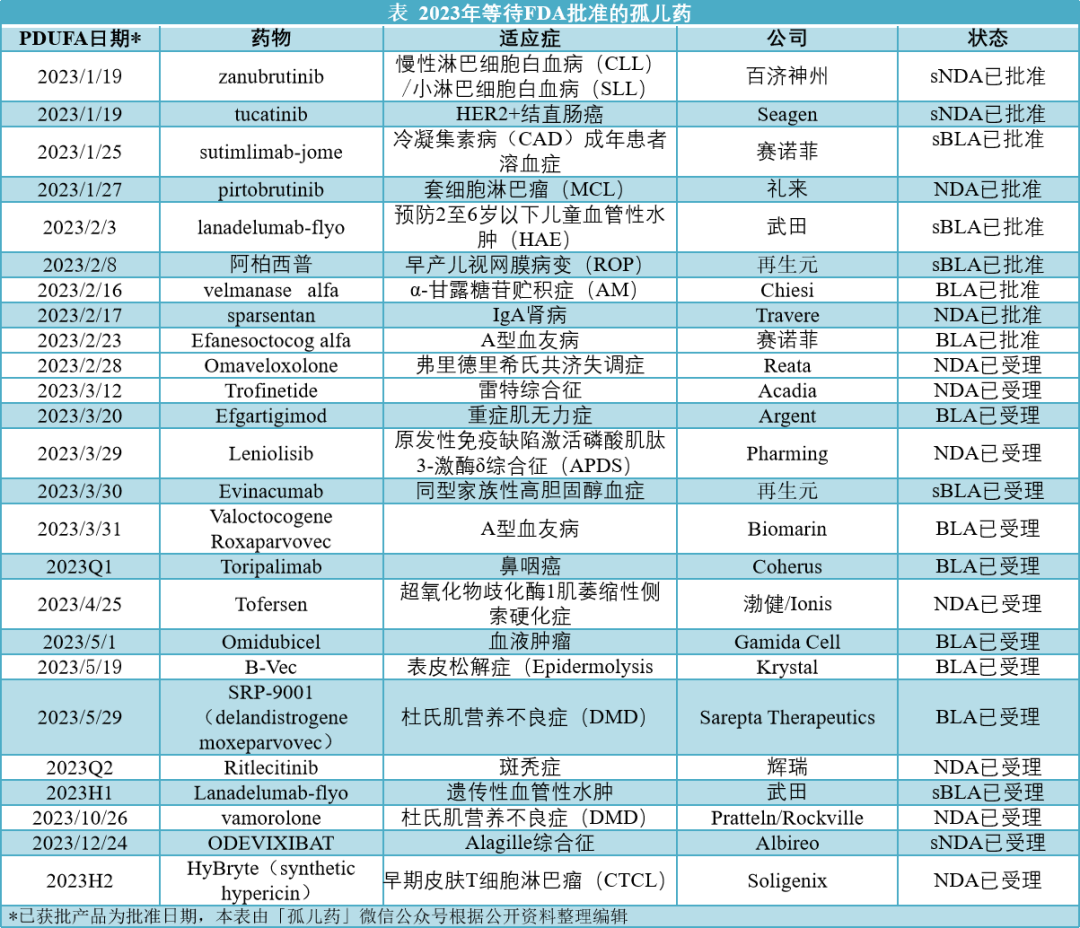
在2023年等待FDA批准罕见病药物名单中,多款药物的新药上市申请/生物制品许可申请(NDA/BLA)或者新增适应症上市许可申请补充申请(sNDA/sBLA)已被FDA受理,而且FDA已明确指定《处方药使用者费用法案(PDUFA)》日期。
截止发稿,已有4款罕见病新药获得批准:
1月27日礼来的Jaypirca(pirtobrutinib)获批用于治疗至少两种系统治疗(包括布鲁顿酪氨酸激酶(BTK)抑制剂)后复发或难治性套细胞淋巴瘤(MCL)的成年患者,是FDA批准的首款非共价(可逆)BTK抑制剂。
2月16日,Chiesi Global Rare Diseases的Lamzede(velmanase alfa-tycv)获批用于治疗α-甘露糖苷贮积症(AM)成人和儿童患者的非中枢神经系统表现,成为FDA批准的首款治疗该疾病的酶替代疗法。
2月17日,Travere Therapeutics的Filspari(sparsentan)获批用于在有高风险出现疾病进展的IgA肾病患者中降低蛋白尿,是FDA批准治疗IgA肾病的首款非免疫抑制疗法。
2月23日,FDA批准了赛诺菲的Altuviiio(efanescoctcog alfa)用于A型血友病成人和儿童患者的常规预防和按需治疗,以控制出血发作以及围手术期管理。
与此同时,有多款药物通过补充上市申请获得批准:1月19日FDA批准了百济神州BTK抑制剂Brukinsa(zanubrutinib,泽布替尼)用于成年慢性淋巴细胞白血病(CLL)或小淋巴细胞白血病(SLL)患者;2月8日,再生元的Eylea(aflibercept,阿柏西普)获得FDA批准用于治疗早产儿视网膜病变(ROP),是FDA批准该适应症的首款治疗药物。此外,Seagen、赛诺菲、武田都有罕见病药物获得新适应症/患者群的批准。
与此同时,也有2款罕见病药物的上市申请遭遇了推迟或者拒绝。
1月9日,Krystal Biotech宣布,FDA在收到其于2022年12月20日提交的制造信息文件后,决定将B-VEC用于治疗营养不良性大疱性表皮松解症的BLA的PDUFA日期推迟至2023年5月19日。
2月14日,Soligenix公司宣布,已收到FDA关于其合成金丝桃素光动力疗法HyBryte(synthetic hypericin)治疗早期皮肤T细胞淋巴瘤(CTCL)新药申请(NDA)的拒绝提交(RTF)信。FDA初步审查后,认定公司于2022年12月14日提交的NDA不够完整,无法进行实质性审查。
更多新突破值得期待
随着对罕见病的深入研究(如临床前模型、遗传学、病理学、生物标志物、成像和临床研究等)和新技术的应用,未来将会有更多罕见病的新疗法问世。
例如,在杜氏肌营养不良症(DMD)疾病领域,尽管目前已有四种外显子跳跃疗法获得FDA批准可用于符合条件的DMD患者,但四款产品加起来仅能够治疗近30%的DMD患者。
随着基因疗法在遗传疾病中越来越受到关注,开发靶向DMD等单基因疾病的潜在病因基因疗法已成为生物制药行业追逐的新领地。今年有望迎来首款DMD基因疗法。
Sarepta Therapeutics公司的DMD基因疗法delandistrogene moxeparvovic(SRP 9001)PDUFA日期为2023年5月29日。医学界专家认为,如果该药物获得批准,新生儿DMD筛查可能会获得批准,这意味着将允许患者在早期阶段接受治疗。
与此同时,也有企业在寻找DMD传统疗法的替代者。
Santhera公司的新疗法vamorolone与糖皮质激素结合相同的受体,但改变了受体的下游活性,潜在地避免了糖皮质激素的副作用。糖皮质激素是目前DMD儿童和青少年患者标准疗法。vamorolone可能成为现有糖皮质激素药物的替代方法。
雷特综合征(Rett syndrome)是一种严重罕见的神经发育障碍疾病。Acadia公司开发的trofinetide,可以改善导致雷特综合征的MECP2基因突变导致的突触和神经元发育不全,其PDUFA日期为2023年3月12日。如果获得批准,trofinetide将成为首款进入美国市场的雷特综合征治疗药物。
肌萎缩侧索硬化症(ALS)是一种由运动神经元退化引起的破坏性疾病,被认为是最有望获得成功治疗的神经退行性疾病。尽管ALS领域已有疾病修饰疗法获得批准,但该领域的研究同样热度不减。据悉,目前已经确定了40多个活跃的临床项目,其中使用反义寡核苷酸(ASO)方法的基因疗法也主导了针对特定ALS基因的临床空间。渤健的tofersen为超氧化物歧化酶1(SOD1)突变所致ALS的治疗提供一种新选择。SOD1 ALS是由SOD1基因突变引起的,该疾病占家族性ALS病例的58.9%。tofersen的PDUFA日期为2023年4月25日。
近年来,随着罕见病药物研发热情和批准数量的持续增长,罕见病领域发生了重大的制药收购案件。从2021年阿斯利康大手笔收购Alexion到近期安进收购Horizon Therapeutics和益普生收购Albireo Pharma,这充分显示出大型制药公司对罕见病领域投资的兴趣持续增加。
从对传统标准的改变到突破式的创新,罕见病新药开发正在以前所未有的速度让这一长期沉寂的领域重新激活,进而推动更多新疗法以满足临床未满足的需求,同时也在改变着生物制药行业未来的投资和发展格局。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..