今日,Amneal Pharmaceuticals宣布美国FDA已经接受其帕金森病新药的上市申请。一旦获批,这款新药有望为帕金森病患者带来新的治疗选择。
作为全球第二大神经退行性疾病,帕金森病影响了全球近千万人的生活,且疾病负担随着全球老龄化的进行,也正在不断加重,根据世界卫生组织今年6月的最新数据,在过去25年里,帕金森病的病例数近乎翻倍,由疾病带来的残疾和死亡也正不断增长,速度超过了任何其他的神经系统疾病。
为了更好地治疗帕金森病,我们需要更多创新的药物。由Amneal带来的IPX203就是这样一款创新疗法。这是一种新型的口服卡比多巴/左旋多巴(CD/LD)缓释胶囊,含有速释和缓释颗粒,以及粘膜附着聚合物,可提供快速吸收并使左旋多巴吸收最大化。
去年8月,这款疗法在3期临床试验中取得了积极成果。这项多中心、随机双盲、活性药物对照的3期临床试验共入组506例年龄为40岁以上的PD患者,其总体结果显示,与活性对照组相比,IPX-203使患者得到具有统计学显著性的症状改善。
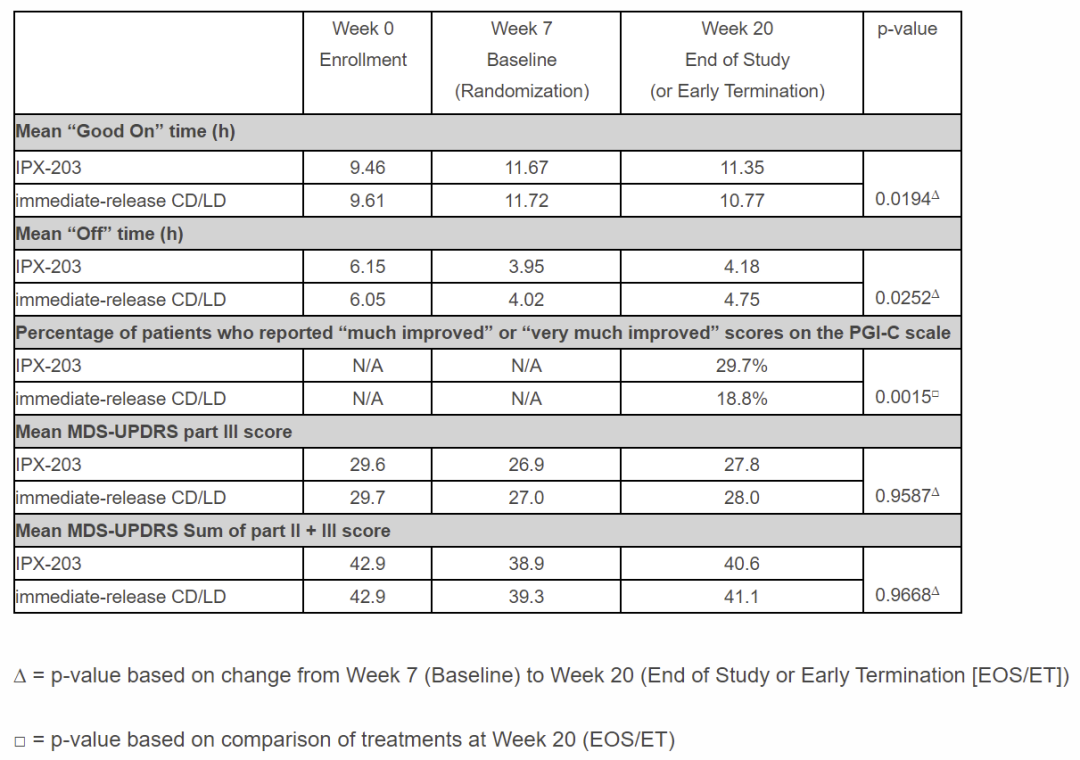
▲试验的主要终点与次要终点关键数据(图片来源:参考资料[2])
当比较两个试验组较基线的变化时,IPX-203治疗导致“Good On”时间比活性对照组多0.53小时(p=0.0194)。此外,与活性对照组相比,IPX-203导致“Off”时间显著缩短(-0.48 h,p=0.0252)。
基于这些结果,该公司在今年向美国FDA递交了上市申请,并于今日获接受。FDA预计在明年6月30日前做出回复。倘若获批,这将为帕金森病患者带来新的希望。
“FDA接受IPX203的上市申请,是Amneal的又一个重要里程碑。”该公司在新闻稿中点评道。未来,该公司也计划于FDA保持沟通,推动这一药物的后续进程。
参考资料:
[1] Amneal Announces U.S. FDA Filing Acceptance of New Drug Application for IPX203 for the Treatment of Parkinson’s Disease, Retrieved November 11, 2022, from https://investors.amneal.com/news/press-releases/press-release-details/2022/Amneal-Announces-U.S.-FDA-Filing-Acceptance-of-New-Drug-Application-for-IPX203-for-the-Treatment-of-Parkinsons-Disease/default.aspx
[2] Amneal Announces Positive Topline Results from Pivotal Phase 3 RISE-PD Clinical Trial of IPX-203 in Patients with Parkinson’s Disease Who Experience Motor Fluctuations. Retrieved August 26, 2021, from https://www.businesswire.com/news/home/20210825005679/en/Amneal-Announces-Positive-Topline-Results-from-Pivotal-Phase-3-RISE-PD-Clinical-Trial-of-IPX-203-in-Patients-with-Parkinson%E2%80%99s-Disease-Who-Experience-Motor-Fluctuations
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..