2018年实施“4+7“集采试点以来,各类药品、高值耗材、IVD试剂相继纳入国家或地方带量采购。集采的直接结果就是产品价格的暴跌,化学药品平均跌55%左右,胰岛素45%,中成药50%左右,高值耗材普遍跌幅在80%以上。
分类与归纳:集采的第一步
尽管集采中选后销量大增,但价格的下跌抵消了整体盈利能力,厂家的普遍心态是能不进集采就不进。探讨某类产品的集采问题,不管是药品还是耗材还是IVD,上来第一句话,往往是:
我们这个产品很特殊,和你们**领域不一样
确实,按哲学家的说法,世界上没有两片完全相同的叶子,万物总有显著或细微的差异。但,哲学家还有下一句:世界上也没有完全不同的两片叶子。是的,尽管有差异,但只要是同一属性的物质,总有共同特征和公共交集。
集采的第一步,就是把这些产品分类,先搁置不同点,然后合并公共交集部分,按交集部分的特点进行分类设定策略。
这是人类归纳思维在医药领域的运用,DRG/DIP分组如此,过去的单独定价、招标采购分组、区分质量层次如此,现在集采亦如此。只不过,集采更加看中产品的统一性,而忽略不太显著的差异。
化学药通过一致性评价解决仿制药与原研的差异
化学药本来是很稳定的,具有同一个化学结构式的物质,但由于历史原因,同一通用名下的产品,原研与仿制药确有较大的差距,但通过一致性评价,这个问题至少在技术上已经解决。因此,在制度上,过评药品与原研同属一个质量层次,大家在质量上不分彼此,可以不再区分质量层次进行招采。
此外,对于剂型的态度,也尽量能合并就合并,口服常释剂型合并、水针与冻干粉合并。如果实在是有显著的差异,比如溶媒结晶与普通粉针,可以适当区分一下,但不在事前分类上区分,而在中选结果后的价格调整上适当区分。
这是化学药在集采实践中积累的方法。不过,要把这些方式引入到生物药、高值耗材、IVD还是不行的,毕竟产品特点差异还是很大。但底层的分类、归纳方法论不变,只需结合产品特点加以改善即可。
事实上,一些看上去成为“集采难点”的问题都不是问题。
胰岛素集采,对冠脉支架像素级的模仿
胰岛素集采,除了吸收武汉对胰岛素竞价分类及采购量分配的经验外,不难发现其对冠脉支架集采的像素级高仿。
选择2-3代胰岛素而舍弃过时的1代,类似于冠脉支架直接越过不锈钢而进入更加优质及广泛应用的钴铬合金材质+药物洗脱产品;
按批件/注册证报名、报量,胰岛素和支架一致,都是尊重产品特点和临床的实际使用;
设置不同价格中选阈值:支架是最低价的1.8倍或2850元,胰岛素是1.3倍或降幅40%;
采购量分配:两者都喜欢对报最高价的“变相惩罚”,匀出一部分采购量给对低价中选者,并允许医疗机构自主选择一部分未报量厂牌......
医保非医保、公立或非公不是障碍:牙种植体和OK镜
事已至此,很多人却还活着梦中。某些公司还以非医保不会纳入集采、或者非公机构不归医保来约束价格来麻醉自己(自欺或欺人?)
事实上,医保局的职能只说是对药品耗材的价格管理,并没说只对医保药品耗材的管理。产品是否是医保,并非是障碍。
早在国采第二批,就陆续有非医保药品纳入集采,这个现象但是我们就给业界提出关注并加以分析,药品行业可能已经对此有认知,但遗憾的是,高值耗材、IVD到现在都没有建立这个认知。
可见,只关注自己的小地盘是不够的,政策制定者是一体的,底层逻辑、方法论都是在实践中不断摸索、积累和相互借鉴的。而企业,反而是割裂的,互不关心、更不学习的。
口腔种植体够难吧?既不是医保项目,也兼具医疗及消费属性,况且民营及公立机构都在广泛开展口腔种植牙服务。看上去,如果强行通过集采,很有可能占比超过一半的民营机构根本不会参与,集采将难以推行。
进入2022年,国家通过对口腔种植体“医疗服务+集采”综合治理思路,确立了非医保项目,以及公立民营机构整体费用偏高解决框架。
而OK镜进集采在很多人的认知中就更扯了,这个产品既不是医保付费,又没有形成广泛的应用,但产品使用的确效果好,唯一的缺点就是贵。对了,贵就是问题!青少年近视具有广泛人群基数,近视程度不断加重、而且逐步低龄化。如果产品的确好使,确能对近视发挥校正作用,那么进入集采岂不是利国利民?
因此,顺着这个逻辑,那么很多原来属于小众但利润丰厚的领域都将一一被击破,似乎再也没有所谓的“利基市场”.
通用型的耗材及试剂,破解国产化率低的“集采难题”
而IVD试剂领域,则与药品、耗材有本质的产品形态差别,试剂不是治疗性产品,不直接作用于人体,但从人体采样后经过仪器的分析,供临床医生进行诊断,是典型的仪器+试剂组合模式,仪器基本靠厂家投放,靠试剂赚钱。
目前,江西牵头的22省肝功生化试剂集采已经来开帷幕,其中纳入集采的试剂品种,基本都是通用型的试剂,其对仪器的开放程度接近一半左右,且国产注册证占比超过96%(戳此可参考文章22省肝功生化集采:产品、厂家、仪器通用性分析)这就具备了大规模集采的前提。
此外,电生理耗材同样如此,对通用型的耗材合并同类项,精挑细选的耗材国产化率不再是可怜的6%,而是超过了一半以上。
生物类似药企业内部的矛盾表达
因此,对于生物类似药集采,不再纠结技术问题。况且,一些类似物厂商内部的思路及诉求都是矛盾的。市场部研究临床使用时着重从类似物与原研产品的“相同”作文章,以打消临床医生处方使用的顾虑;而准入部门为了规避集采,则在“外推性”上着眼,最终诉求莫过于我们之间“不一样”!
同一家企业,相反的诉求,这不是很可笑吗?真的以为临床医生和医保局信息是相互屏蔽不沟通的?
相关数据已经显示,贝伐珠单抗的销量已达30亿元左右,阿达木单抗也是国产远超原研,大家都已集齐至少5家以上,集采之路即将打开。
生物类似药集采不存在禁区
生物制剂纳入集采已经不是什么新鲜事,国家集采第六批就是专门针对胰岛素,而广东联盟276集采中也有血液制品、生长激素、干扰素及生物类似药(利妥昔单抗)。
但业界对生物药,尤其是生物类似药进集采却高度关注,因为我国2019年才诞生第一个生物类似药---复宏汉霖的汉利康,尽管短短2-3年的努力,国内目前在阿达木单抗、贝发珠单抗、利妥昔单抗等相继注册上市类似物。
生物类似药虽然在我国起步较晚,但近年来进展加快。阿达木单抗类似药已有百奥泰、海正药业、信达、复宏汉霖、正大天晴、君实生物等6家获批上市;贝伐珠单抗类似药更是有齐鲁制药、信达生物、绿叶制药等8家企业获批,曲妥珠单抗首个生物类似药也获批上市。
此外,除上述企业外,恒瑞、绿叶等10多个药企都在申报上市或者进入临床试验阶段,生物类似药在未来几年内将陆续登场,形成较为充分的竞争状态,满足带量采购的基本前提。从国内生物类似药市场竞争格局来看,已经达到了充分竞争条件,并从市场规模来看也已具备了一定的规模。
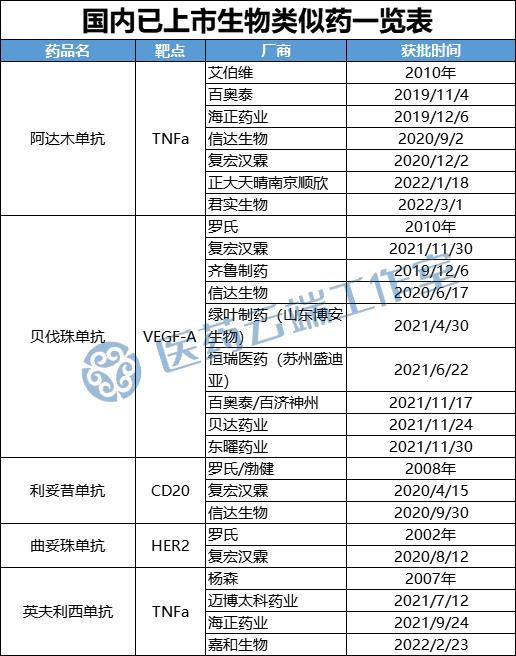
国家对集中带量采购的态度是“集采无禁区”,包括生物类似药在内的药品、高值耗材及IVD试剂,都结合产品、行业、临床应用等不同特点,用不同方式分别一一突破集采难点。
国家医保局多次发布消息,有意释放出“将生物类似药纳入集中带量采购”。而目前胰岛素在武汉探索实践后,国家专项结合武汉实践及高值耗材集采的经验组织集采,取得都了一定经验。
广东11省联盟276品种集采,也将利妥昔单抗在内的18个生物制剂纳入其中,如下表所示:
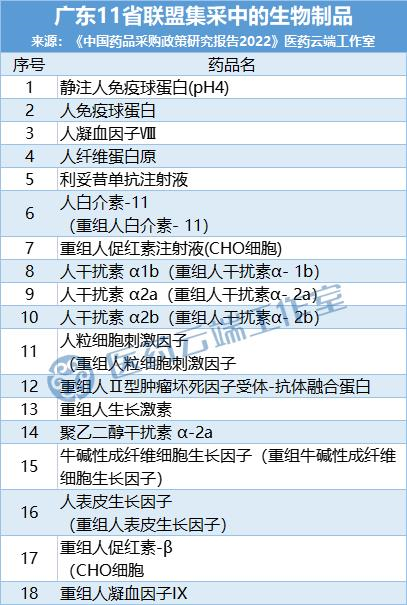
广东11省集采联盟中,利妥昔单抗是首次进入集采,广东成为了生物类似药集采的“第一标”,其竞争格局及报价都将成为日后集采项目的参考。
利妥昔单抗医疗机构报量约为1.6万支,罗氏、复宏汉霖、信达生物的占比分别是63.50%、35.11%、1.39%。最终,信达以59%的降幅成为中选企业,而罗氏及复宏汉霖分别降价16%、49%获得备选资格。
11月1日,河北发出《中成药和生物制剂规范挂网实施方案》,同时公布了生物制剂通用名相同或类似物分组情况,尽管这是针对该省的挂网采购,但由于涉及产品分类、分组的底层逻辑,对于带量采购在内的任何一种采购方式都值得借鉴。(中成药部分分析详见前文,请戳中成药、生物制剂采购分组问题的技术解法:河北再次给我们启发)
从该省对生物制剂分组情况来看,解决了各类生物制剂通用名相似、相同、以及类似物相同或不同类别的区分问题。
如下两个表格所示:
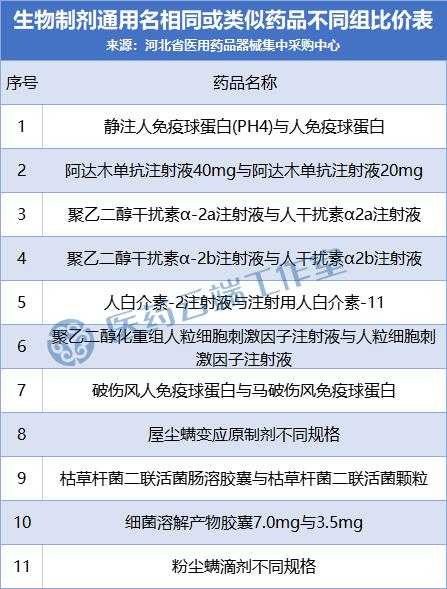
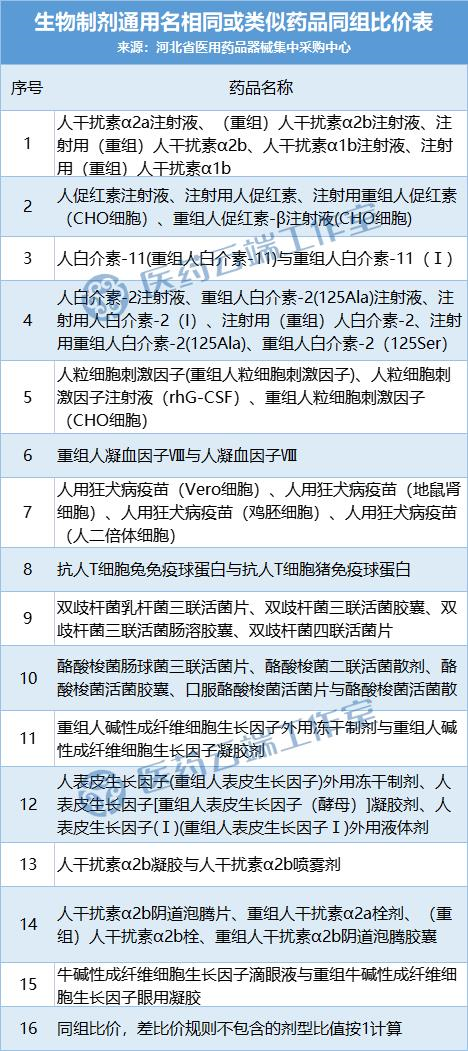
与此同时,国家也在积极考虑生物药的集采方式。
10月12日,国家医疗保障局发布《关于政协十三届全国委员会第五次会议第03703号 (医疗卫生类329号) 提案答复的函》,对朱弈龙委员提出的关于引入新型创新药准入评价机制的提案进行了答复。
除了医保准入,进入集采也是创新药获得市场的重要途径之一。不过由于生物制品无法开展生物等效性(BE)试验,相对于化药纳入集采需要考虑的因素将更多。
国家医保局在答复中表示我们将在现有集采成功经验基础上,结合生物药的特点,不断完善生物药集采规则。
其实此前,国家医保局多次发布消息,有意释放出“将生物类似药纳入集中带量采购”。而目前胰岛素已经在武汉探索实践后,国家专项组织集采,均取得了一定经验。
至此,生物类似药集采在技术层面、行业共识层面基本没有太大问题,集采似乎只剩下时间安排了。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..